La Chimie chez Dr Sahar
Sponsors
mercredi 13 août 2014
Les Implications et le développement d’une théorie scientifique
mardi 5 août 2014
Généralités sur les verres
Définition des verres et leurs propriétés
Structure du verre
Classification des verres
Historique
Le verre est un des plus anciens matériaux de l’humanité, on peut le trouver à l’état naturel dans certaines roches d’origine volcanique ou météorique. Sa fabrication par l’homme remonte à la plus haute antiquité, la date de naissance du verre n’est pas facile à fixer avec précision, car elle varie avec le degré de sévérité adopté pour définir le verre, d’après MOREY .Les plus anciennes pates vitreuses étaient connues depuis environ 1200 ans avant Jésus-Christ, le verre pur date de 7000 ans avant Jésus-Christ. Les verres ont été trouvés en Egypte et ils ont été probablement ramenés d’Asie.
A l’occident, la fabrication du verre était dispersée sur des sites isolés après la chute de l’empire romain, mais elle était connue à Byzance et plus tard au moyen orient par les arabes. En l’année1300, Venise devenait le lieu de la naissance de l’industrie du verre en Europe, le progrès dans les techniques du verre et ses applications par la suite était rapide.
Le début de l’industrie artisanale du verre qui correspondant à l’utilisation de soufflage se situe au début de notre 15éme siècle. Au 17éme siècle avec le développement des connaissances dans le domaine de l’optique, sont apparus les premières instruments d’observations utilisant le verre (lunette télescope …) .L’industrie verrière pour la fabrication de bouteilles et de verres à vitres a commencée aux Etats Unis au début du 18éme siècle. En 1879, Monsieur Thomas Edison a inventé l’ampoule incandescente qui a changée les vies des millions de personnes tout autour du monde. C’est une application typique qui n’est possible sans l’utilisation de verre qui lui seul satisfait les propriétés nécessaires pour le fonctionnement : dureté, transparence, tenir le vide et résister aux températures élevées en même temps. Avec le progrès technologique, le champ d’application du verre n’a cessé de s’étendre surtout dans l’optique pour la fabrication des composants optiques tels que : les lentilles, les prismes, miroirs….etc. Son large spectre d’utilisation, la rendue indispensable dans des application fines de haute précision . Pour cette raison il a été classé comme «matériau noble» par la communication scientifique.
I.1. Définition du verre
Le verre est définit comme étant une substance dure homogène, généralement transparente, amorphe,isotrope, provenant du refroidissement progressif de certaines substances après fusion. Il est facile à modeler, peut prendre de nombreuses formes.
· Dans le langage scientifique, on désigne par le terme verre, un solide non cristallin obtenu par figeage d’un liquide surfondu.
· Dans le langage courant le terme verre sert à désigner un matériau fragile et transparent au rayonnement visible .
On trouve également d’autres définitions telles que « le verre est un solide amorphe de substance inorganique formé par solidification sans cristallisation ».
L’ASTM «Américain Society for Testing Matériels » définit le verre comme un produit minéral obtenu par fusion et qui se solidifie sans se cristalliser prend un état figé .
I.2. Structure du verre
Dans tout solide, il existe entre les éléments constituants un certain arrangement qui détermine sa structure. Il en est ainsi pour le verre, les éléments constitutifs du verre de silice sont les tétraèdres SiO4 qui sont assemblés par les sommets par des ions O-2 figure (I.1). Dans le cas de la structure cristalline (quartz) l’angle Si-O-Si est constant et égale à 140º, alors qu’il peut varier dans le cas de silice vitreuse autour d’une valeur moyenne de 145º. Cela suffit pour que le réseau de silice vitreuse soit désordonné.
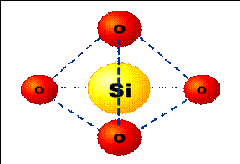 |
Figure. I.1 : Représentation schématique de la structure du verre de silice .
Le verre est un état instable de la matière, sa structure comporte un ordre à courte distance et un certain désordre si l’on considère un volume suffisamment grand .De ce fait, le terme solide non cristallin, solide amorphe et verre sont synonymes et présentent le phénomène de la transition vitreuse.
On peut obtenir des renseignements plus précis sur la structure du verre, en étudiant celle du liquide à partir du quel et en dépendance des conditions de refroidissement et de composition, le verre prend deux formes de structure figure (I.2).
· Refroidissement lent et composition quelconque : formation d’un réseau ordonné cristallisé (quartz, cristobalite) figure (I.3 a).
· Refroidissement rapide: on à la formation d’un réseau désordonné, arrangement irrégulier c’est une structure vitreuse « verre de silice » figure (I.3 b) .
| |
Figure.I.2 : Shéma montrant la variation du volume en fonction de la température .
Le verre est privé de l’arrangement parfait de l’état cristallin. Sa structure est aléatoire. Elle ne présente pas d’ordre à longue distance comme pour les solides cristallins, tandis que les cristaux ont des liaisons régulières et identiques entre tous les atomes. Les liaisons dans le verre sont souvent perturbées, déformées et cassées.
L’introduction de l’oxyde alcalin, comme l’oxyde de sodium Na2O, pour le verre sodocalcique, coupe les liaisons Si-O. Le réseau se trouve rompu et il y existe des discontinuités. Figure (I.3c)
| |
Figure.I.3 : Représentation schématique d’un réseau plan de silicate .
a-Silice cristalline (Cristobalite), b-Verre de silice, c-Verre sodocalcique.
I.3. Composition chimique des verres
Les verres sont pour la plupart des verres, des oxydes, pour fabriquer le verre, un ensemble de matières premières est utilisé constitué en majeur partie des rôches naturelles (sable calcaire) et des produits chimique, tels que le carbonate de sodium, le mélange hétérogène s’appelle mélange vitrifiable.
Il existe un nombre important de types de verre qui diffèrent suivant leurs compositions, leurs propriétés et leurs applications, les différentes composition du verre se compte aujourd’hui par milliers, suivant les caractéristiques chimiques de leurs composants principaux, on peut les classer en cinq catégories, verres d’oxydes, les verres d’halogénures, les verres métalliques et les verres obtenus à partir de sels ioniques et solution aqueuses.
Certains éléments comme le silicium et le bore peuvent former un verre par leur seul combinaison avec de l’oxygène par élévation à une très haute température. Ces oxydes sont appelés oxydes formateurs car ils forment le squelette du verre. On les combine avec d’autre élément dits « modificateurs » qui sont :
Ø Les fondants qui abaissent la température de fusion des oxydes formateurs (température de la silice est 1730°C).
Ø Les stabilisants qui modifient les propriétés physiques du verre atténuées par l’adjonction du fondant .
I.3.1. Oxydes formateurs
Ce sont des oxydes principaux, utilisé en grandes proportion pour former le réseau vitreux dont les plus importants sont : SiO2 verres à base silicates, B2O8 verres à base de borate, P2O8 verres à base de phosphate, et que pour chacun de ces formateurs, on peut introduire ensemble ou séparément des modificateurs très nombreux dont certains peuvent être partiellement formateurs, on peut voir l’étendue assez importantes de composition des verres possibles .
I.3.2. Oxydes modificateurs
Les oxydes modificateurs sont essentiellement, les oxydes alcalins par exemples Na2O, K2O ou bien des oxydes alcalino-terreux par exemples CaO. Ce sont essentiellement des composés ioniques. Les oxydes modificateurs dépolymérisent les réseaux des oxydes formateurs en détruisant ou bien alternant la structure de base, ce qui explique le rôle des modificateurs dans l’abaissement de la température de fusion des verres.Ils sont ajoutés pour faciliter la fusion des vitrifiant en s’insérant dans le réseau vitreux (rupture des ponts d’oxygènes ou oxygènes non pontant) et pour modifier les propriétés du verre formé par l’oxyde formateur, ces oxydes sont des composés ajoutés à la composition du verre, en quantités maîtrisées dont on peut citer :
· Na2O (oxyde de sodium) : obtenue à partir de carbonate de sodium Na2CO3, il abaisse la viscosité et la résistance chimique, augmente le cofficient de dilatation thermique, et la conductivité électrique.
· Li2O (oxyde de lithium) : qui augmente l’amplitude à la diffraction en diminuant la viscosité .
· CaO (oxyde de calcium) : obtenue à partir du calcaire CaCO3, il améliore la résistance chimique des verres en diminuant leur solubilité .
· K2O (oxyde de potassium) : obtenue à partir du carbonate de potassium K2CO3, agit sur la viscosité en augmentant ainsi l’intervalle de travail des verres .
· MgO (oxyde de magnésium) : améliore les caractéristiques de résistance des verres.
· BaO ( oxyde de baryum) : augmente l’indice de réfraction, d’où son application dans les verres optiques.
I.3.3. Oxydes intermédiaires
Ce sont généralement des oxydes qui ne sont pas capables de former un verre. Ils peuvent prendre une place dans la chaîne du verre. L’oxyde d’aluminium est un exemple d’un tel oxyde intermédiaire. Il joue le rôle de colorants ou d’affinant dans la composition chimique du verre. Les oxydes intermédiaires sont ajoutés en petites quantités dans le mélange vitrifiant. On peut citer AS2O3, AL2O3, CaDO….etc . Ainsi par variation de la composition chimique des composants et l’addition des divers oxydes, les propriétés mécaniques, optiques, thermiques et chimiques du verre sont améliorées. Dont les oxydes intermédaires sont classées en :
![]() Affinants : ont pour fonction essentielle, de favoriser l’élimination des bulles gazeuses présentes dans le verre en fusion, parmi ces oxydes, on a essentiellement l’oxyde d’antimoine et les nitrate d’alcalins .
Affinants : ont pour fonction essentielle, de favoriser l’élimination des bulles gazeuses présentes dans le verre en fusion, parmi ces oxydes, on a essentiellement l’oxyde d’antimoine et les nitrate d’alcalins .
![]() Colorants : sont des oxydes de métaux de transition, utilisés dans les verres de couleur dits aussi verres ambrés, dont la couleur varie entre le jaune doré au marron foncé
Colorants : sont des oxydes de métaux de transition, utilisés dans les verres de couleur dits aussi verres ambrés, dont la couleur varie entre le jaune doré au marron foncé
.Tableau.1 : Compositions chimiques moyennes (en poids) de quelques verres silicates.
|
Oxyde | Sodocalcique | Borosilicaté | Aluminosilicate | Au plomb | De silice |
| SiO2 | 70.0 - 75.0 | 73.0 - 81.0 | 57.0 | 53.0 – 68.0 | 96.0 |
| NaO2 | 12.0 – 18.0 | 3.0 – 18.0 | 1.0 | 5.0 – 10.0 | - |
| K2O | 0.0 – 1.0 | 0.4 – 1.4 | - | 1.0 – 10.0 | - |
| CaO | 5.0 – 14.0 | 0.0 – 1.0 | 5.5 | 0.0 – 6.0 | - |
| PbO | - | 0.0 -10.0 | - | 15.0 – 40.0 | - |
| B2O3 | - | 5.0 – 20.0 | 4.0 | - | 4.0 |
| Al2O3 | 0.5 – 2.5 | 2 – 3 | 20.5 | 0.2 | - |
| MgO | 0.4 | - | 12.0 | - | - |
I.4. Classification Des Verres
Il existe un nombre important de types de verres, qui différent suivant leurs compositions, leurs propriétés et leurs applications. Suivant les caractères chimiques de leur composants principaux, on peut classer les verres en deux catégories: les verres d’oxydes et sans oxydes ; comme on peut aussi les classer selon leurs qualités : verres naturels et verres artificiels.
I.4.1. Selon la composition chimique
Suivant les caractères chimiques de leurs compositions principaux, on peut les classez en deux catégories.
I.4.1.1. Verre d’oxydes
Les verres d’oxydes sont particulièrement importants du point de vue pratique. La plupart des verres d’oxydes usuels sont obtenues par confusion de SiO2 avec des oxydes alcalins ou alcalino-terreux (modificateur des réseaux), suivant la nature des oxydes qui sont présents avec la silice.On distingue :
a. Verres sodocalciques
Ils sont très utilisés pour la fabrication du verre plat et du verre creux.Ce sont les verres les plus courants qui représentent à eux seuls 90% des verres fabriqués dans le monde.Leurs qualités mécaniques ne sont pas exceptionnelles. Mais ils sont faciles à fondre et pour une utilisation à grande échelle, ils présentent l’avantage d’être bon marché. Ils sont surtout utilisés pour leur transparence.A la silice on ajoute de la soude pour abaisser la température de fusion (abaissement de Tg) et de la chaux comme stabilisant. La composition chimique contient essensiellement l’oxyde de silicium (SiO2) ~72%, l’oxyde de sodium (Na2O) ~14% et l’oxyde de calcium (CaO) ~9%.
En général, ils contiennent en plus d’autres composants avec des faibles quantités, dont certains sont introduits accidentellement par les matières premières, tandis que les autres sont intentionnellement, par exemple l’alumine (Al2O3) et la magnésie (MgO) qui peuvent améliorer la durabilité chimique du verre et retarder la dévitrification.
b. Verres borosilicates
Les verres borosilicates sont composés principalement de silice et d’anhydride borique
Appartiennent à cette famille, tous les verres dont la teneur en anhydride borique B2O3 est supérieure à 5% et la teneur on oxyde alcalins est inférieure à 10%. Ils se travaillent facilement à chaud. Les verres de borates sont rendus moins sensibles à la corrosion par ajout de Al2O3 ou de composés de terres rares.
L’introduction d’anhydride borique B2O3 dans les compositions traditionnelles de verre permet :
· De diminuer la viscosité, la tension superficielle et le coefficient de dilatation,ces verres à faible coefficient de dilatation qui leur assure une meilleure résistance aux chocs thermique par ropport aux verres sodocalciques ;
· D’améliorer la transmission dans l’UV ;
· D’obtenir des verres à faible indice de réfraction et à forte dispersion, l’utilisation de l’anhydride borique a permet d’obtenir des verres dits durs.
Ils sont utilisés principalement dans l’appareillage de laboratoires, dans l’isolation électrique et comme verres de cuisson (verre pyrex).
c. Verres aluminosilicates
Ces verres se caractérisent par une teneur en alumine Al2O3 égale ou supérieure à 20% et par des teneurs plus faibles en chaux CaO et magnésie MgO, ils contiennent très peu d’oxydes alcalins Na2O et K2O, parfois de l’anhydride borique B2O3, ces verres sont plus difficiles à fondre et à travailler que les verres borosilicates, leur point de ramollissement TL est suffisamment élevé pour leur conférer une température d’utilisation voisine ou inférieure à 670°C.Ces verres se caractérisent par une bonne durabilité chimique et une bonne résistance aux chocs thermique, ils sont aussi plus résistants à la dévitrification,ils permettent de réaliser des isolateurs et surtout des fibres (verres E) utilisés en électronique, l’adjonction des différents oxydes intermédiaires produit des effets divers : PbO, croit la dispersion et l’indice de réfraction et donne un verre brillant utilisé pour les verres de protection contre les rayons X .Ils sont utilisés dans les applications électriques, électronique et comme fibres de renfort dans les matériaux composites.
d. Verres au plomb
Le remplacement de la chaux par de l’oxyde de plomb permet de diminuer la viscosité et d’obtenir des verres plus facile à travailler à chaud, d’autre part, l’oxyde de plomb à une très forte influence sur les caractéristiques électriques du verre et sur le facteur d’absorption des rayons X, les verres à moins de 30% d’oxydes de plomb sont utilisés pour la réalisation de condensateurs et pour l’encapsulage de micro diode.Le verre à base d’oxyde de plomb appelé cristal, il est braillant très limpide et possède un indice de réfraction de la lumière très élevé .C’est pourquoi on l’emploie pour fabriquer des lentilles et des prismes, ainsi que des bijoux. Les verres à base de plomb entrent également dans la composition des écrans protecteurs portés par le personnel travaillant sur les installations nucléaires.
I.4.1.2. Verres sans oxydes
Il est évident qu’il ne faut pas limiter les lois de la vitrification aux oxydes, mais qu’il faut les considérer d’une manière générale. Dans ce qui suit, on présentera une sélection parmi les nombreuses possibilités qui se présentent.
a.Verre d’halogénures
Ces verres ont pris une importance toute particulière du fait de leurs propriétés optiques exceptionnelles .On peut citer : B2F2, ZnCl2, RF2 ; Le fluorure de beryllium BeF2 est un «formateur» de réseau isostructural affaibli de la silice. Qui en est fait de très bons candidats, comme matériaux pour lasers de grande puissance envisagés notamment pour la fusion thermonucléaire .
b. Verres chalcogénures
Les verres de chalcogénures sont des matériaux originaux qui ne contiennent pas d’oxygène. Les verres Ge-As-Si et Ge-As-Se ont un indice de réfraction élevé et présente de faibles pertes acoustiques: ils sont susceptibles d’applications acousto-optiques comme modulateurs et déflecteurs de faisceaux infrarouges.D’une part à cause de leur aspect opaque à la lumière visible, qui rappelle d’avantage celui d’un métal que celui d’un verre d’oxyde traditionnel comme la silice, et d’autre part à cause de leurs nombreux domaines d’utilisations potentielles .
c. Métaux vitreux (GLASING)
Les verres métalliques peuvent être classés en deux types principaux :
ü Alliages Métal-Métalloïdes : Pb-Si, Fe-Ni-P-B, FeB,…
ü Alliages Métal-Métal : Ni60Nb40, Ni-p, Au-Si,…
Ces verres métalliques sont obtenus par trempe ultra-rapide d’alliages. Leur structure est essentiellement de type compact désordonné. Ils possèdent des propriétés mécaniques intéressantes; leur résistance mécanique est plus élevée et ils ont une ténacité importante.
I.4.2. Selon l’origine
I.4.2.1. Verres naturels
Les verres naturels sont formés dans la nature par des processus qui engendrant une élévation de température suivie d’un refroidissement brutal. La vitrification naturelle se produit en général lorsque la lave éjectée par les volcans arrive à la surface de la croûte terrestre et subit un refroidissement brutal ou trempe rapide.
Parmi les roches éruptives qui peuvent contenir des proportions plus ou moins élevées de phases vitreuses, on trouve les bloques de verre de silice, et les obsidiennes qui sont des verres naturels avec une composition voisine de celle des verres industriels courants .Les obsidiennes sont colorées en noir, gris, ou brun rouge, à cause des impuretés (Fe, Mn, etc.) qu’elles renferment. Elles contiennent moins de 3% d’eau. Du fait de leur refroidissement rapide, les verres volcaniques présentent souvent des tensions internes, ce qui les rend biréfringents .
I.4.2.2. Verres artificiels
Ce sont les verres industriels et les verres optiques (verres d’oxydes, verres sans oxydes).
a. Verres industriels
On entend par verre industriel, tout verre à usage courant et à grande échelle de production, tel que le verre plat, le verre creux et le verre de laboratoire. Les verres industriels sont caractérisés par :
Ø Une légère coloration qui varie du bleu verdâtre au vert jauâtre due aux impuretés colorantes qu’ils contient ;
Ø Une non homogénéité par rapport aux verres optiques ;
Ø Leurs biréfringences à cause des contraintes internes permanantes.
b. Verres optiques
Ils différent des verres industriels par les soins particuliers que nécessitent leurs productions et les propriétés qui en découlent sans parler de la composition chimique .Les verres d'optique sont des verres très particuliers pour les quels l'homogénéité doit être très grande.
Les propriétés essentielles recherchées :
· une bonne transmission de la lumière ;
· une faible coloration ;
· une homogénéité presque parfaite ;
· une faible biréfringence ;
· leur indice de réfraction bien déterminé avec une grande précision également au nombre d’Abbe. À l’aide de ce dernier, on classe les verres comme se suit :
- Verre flint : C’est un verre constitué à base d’oxyde de plomb, il a un indice de réfraction élevé, il existe deux types de verre flint : le léger et le flint lourd.
- Verre crown : C’est un verre sodocalcique de faible indice de réfraction .
Les verres d’optique sont utilisés dans la plupart de temps comme des lentilles de lunettes, microscopes, télescopes, appareils photographiques…etc.
I.5. Propriétés des verres
Du fait de leur structure non cristalline, les verres possèdent un certain nombre de propriétés caractéristiques. Dont on cite :
I.5.1. Propriétés mécaniques
Les propriétés mécaniques peuvent être définies comme étant, l’ensemble des caractéristiques qui déterminent le comportement d’un matériaux sous l’effet d’efforts mécaniques exterieurs. Les verres sont caractérisé par une grande fragilité qui constitue leurs point faible, une résistance mécanique faible en flexion, une ténacité très faible et une dureté relativement grande.
I.5.1.1. Elasticité
Un corps est dit élastique si sous l’action d’une force de sollicitation, il engendre une déformation réversible dite élastique ; celle-ci disparait par suppression de cette force appliquée .Le verre de silice a à la température ambiante un comportement linéaire élastique jusqu’à la rupture, les premières mesures ont montré qu’on peut caractériser un verre par un module d’élasticité, ça sera le cas si la structure vitreuse est rigide, il y a en effet une diminution du module d’élasticité quand la teneur en Na2O augmente, et il en est de même quand la température augmente.
Tableau I.2 : Propriétés élastiques de quelques verres industriels
| Propriétés | Verre Sodocalcique | Verre Borosilicates | Verre Aluminosilictes | Verre au Plomb | Verre de Silice | Verre de pyrex |
| Module de Young (GPa) | 70 à 73 | 64 | 83 | 58 à 60 | 72 à 74 | 62 |
1.5.1.2. Dureté
Elle est définit comme étant la résistance à la déformation permanante par un chargement concentré d’un autre matériau plus dur .La dureté d’un matériau, dépend non seulement des caractéristiques du matériau testé, mais aussi de la nature, de la forme et du mode de l’indenteur. Il existe différents essais de dureté correspondant à différentes géométries d’indenteurs.
Figure .I.4 : Principaux indenteurs .Tableau I.3 : Dureté mécanique de quelques verres, pour une charge de 5N.
| Type de verre | Dureté Vickers (Hv) en GPa | |
| Silice 96% | 6.96-7.06 | |
| Sodocalcique à vitre | 4.51 | |
| Sodocalcique trempé | 4.90 | |
| Au plombe faible | 4.41 | |
| Au plombe élevé | 2.65 | |
| Borosilicate | 5.69 | |
| Aluminosilicate | 5.75 | |
I.5.1.3. Ténacité
La ténacité est définie comme étant la capacité d’un matériau à résister à l’initiation et à la propagation des fissures préexistante.
La ténacité peut être considérée comme l’une des plus importantes propriétés des matériaux fragiles. Le comportement fragile à la température ambiante des verres est attribué à une faible ténacité. Elle dépend de la géométrie de la pièce, de la taille des fissures existantes et du mode de chargement.
La ténacité est quantifiée par le facteur d’ntensité de contrainte critique K1c ,Nous donnons à titre d’exemple la formule de Laugier proposée pour le système de fissuration Palmqvist.
K1c=0,015 (E / Hv) 3.2. (l/a)-1/2. (F/C3/2) (I.4)
Et la formule de Anstis et al [12] qui est proposée pour le système de fissuration médian/radial
K1c = 0,016 (E / Hv )1/2 (F /c 3/2) (I.5)
Où :
K1c : Facteur d’intensité de contrainte critique ;
F : Charge d’indentation ;
2c : Longueur de deux fissures radiales adjacentes plus la diagonale de l’empreinte ;
2a : Diagonale de l’empreinte Vickers ;
Hv : Dureté Vickers.
Tableau I.4 : Valeurs du KIc pour quelques verres
| Type de verre | Verre de Silice | Verre Sodocalcique | Verre Aluminosilicate | Verre Borosilicate | Silicate de plombe |
| KIc [MPa.m1/2] | 0.74 - 0.81 | 0.72 - 0.82 | 0.85 - 0.96 | 0.75 – 0.82 | 0.62- 0.73 |
I.5.2. Propriétés thermiques
Les propriétés thermiques des verres sont directement liées aux changement de température, ce sont essentiellement : la viscosité, la chaleur spécifique, le coefficient de dilatation thermique et la conductivité thermique. Le comportement du verre à la déformation thermique est assez complexe. En effet, le verre est un solide élastique aux températures inférieures à la température de transformation (Tg). Aux températures suffisamment élevées, il présente les propriétés d’un liquide visqueux. Le passage d’un comportement à l’autre est continu (contrairement aux solides cristallins). Dans le domaine intermédiaire les verres montrent un comportement viscoélastique.
I.5.2.1. Viscosité
C’est la résistance frictionnelle qu’oppose un fluide à l’action d’une force qui tend au maitre en mouvement. La viscosité ŋ est la propriété la plus importante des verres industriels .Elle est mesurée en poise. La poise est la viscosité lorsque la force de frottement exercée sur une surface de 1cm2 est de 10-5 N pour une variation de vitesse dv=1cm/s sur une distance dn=1cm.
1 poise =1dyN.S/cm2 ou 10-5 N.S/cm2.
La viscosité n’est pas seulement une propriété essentielle pour la fabrication et le formage du verre, mais elle dépend aussi étroitement de la nature et de la structure du verre fondu [11]. Par exemple pour le verre sodocalcique, la viscosité à la température ambiante est 1019 poises et 1012 à la température Tg.
La figure (I.5) représente la variation de la viscosité d’un verre sodo-calcique en fonction de la température.
Figure.I.5: Variation de la viscosité d’un verre sodocalcique en fonction de la température.
Lorsque la température s’éleve, la viscosité du verre diminue d’abord lentement puis rapidement et à nouveau plus lentement pour atteindre aux températures de fusion une valeur de 102 poises .
Dans un liquide et donc dans un verre fondu qui est un liquide, les éléments structuraux individuels ont une grande possibilité de déplacement du fait que les liaisons interatomiques sont rompues dans tout corps, l’énergie nécessaire pour rompre ces liaisons est introduite sous forme d’énergie thermique.
Pour les verres et au moment d’atteindre le point de fusion le verre fondu présente une grande viscosité, plus la température est élevée, plus il ya de liaison rompues et plus la viscosité est faible, inversement les liaisons se referment par refroidissement, ce qui augmente la viscosité dans les systèmes binaires de silicates alcalins.
Tableau I.5 : Rapport des coefficients de viscosité de quelques verres à l’état liquide et à l’état pratiquement solide.
| Verre | Viscosité ƞ0 à 950°C | Viscosité ƞ1 à 1300°C | Rapport ƞ0/ ƞ1 | |
| Verre sodocalcique. | 24600 | 260 | 94.61 | |
| Verre à vitres sodocalcique | 63000 | 500 | 126 | |
| Baryum-crown contenant 42% de BaO | 65000 | 25 | 2600 | |
|
Verre sodocalcique contenant 5% Al2O3 | 35000 | 630 | 55.55 |
I.5.2.2. Dilatation thermique
Lorsqu’ils sont chauffés, la plus part des solides manifestent des variations dimensionelles réversibles correspondant au phénomène dit de dilatation thermique, résultant du mouvement des atomes ou groupes d’atomes constituant le solide .
La dilatation thermique est étudiée immédiatement après la viscosité .Elle est caractérisée par un coefficient de dilatation linéaire (α) ou volumique (β).
α∆T =∆L / (L0. ∆T) (I.6)
β∆T= ∆V/(V0.∆T) (I.7)
Où :
α, β : sont donnés en (°C-1 ou k-1 ) ;
∆L: variation de la longueur ;
∆V : variation de volume ;
∆T : variation de température ;
V0 : volume initial de l’échantillon.
Le coefficient de dilatation linéaire se détermine par dilatomètrie, entre la température ambiante et la température de transition vitreuse Tg, pour la plupart des verres, le coefficient de dilatation augmente avec la température. Il est donc nécessaire lorsqu’on donne une valeur du coefficient de dilatation linéaire α, de préciser l’intervalle de température dans lequel il a été déterminé .
Lorsque la température augmente, l’énergie thermique augmente et il en résulte un accroissement de l’amplitude de vibration des particules. Cela signifie que lorsque la température s’élève, il se produit une dilatation à l’échelle macroscopique. Lorsque on ajoute à la silice un oxyde non formateur (oxydes alcalins), les oxygènes supplémentaires introduits viennent participer au réseau en provoquant la rupture d’un certain nombre de liaisons, donc l’introduction d’oxyde alcalin augmente la dilatation pour une teneur constante en alcalins .
Tableau I.6 : Coefficients de dilatation de quelques verres commerciaux pour un intervalle de température de 20 à 300 °C.
| Type de verres | Coefficients de dilatation α° C-1 (10-6) |
| Sodocalcique | 8.5 |
| Borosilicate | 3.3 à 5.0 |
| Aluminosilicate | 5.2 |
| Verre Au plomb | 9.4 |
| Verre De silice | 0.6 |
| Verre pyrex | 3.2 |
I.5.2.3. Conductivité thermique
Les verres sont des mauvais conducteurs de chaleur par rapport aux métaux. C’est la raison pour laquelle il est facile de les travailler au chalumeau sans risque de brûlures.La conductivité thermique détermine la vitesse de la variation de la température qui peut subir le verre lors de la fabrication et les usages courants.
λ = (-dQ / dt) / (S.dT /dx) [W/m.K] (I.8)
Tableau I.7: Valeurs de la conductivité pour quelques verres à la température 25°C
| Types de verre | Conductivité thermique [W/m.K] |
| Verres sodocalcique | 1,00 |
| Verres aluminosilicate | 1,03 |
| Borosilicate | 1,1 |
| Silce vitreuse | 1.38 |
I.5.2.4. La chaleur spécifique
La chaleur spécifique représente la quantité de chaleur absorbée par unité de masse du matériau quand il s’échauffe de 1°C. Elle mesure la quantité d’énergie thermique nécessaire pour changer la température du matériau.
Elle croit avec la température et tend vers zéro quand la température tend vers le zéro absolu. Et dépend étroitement de la composition chimique. Les verres qui contiennent des constituants dont la masse atomique est élevée ont des chaleurs massiques plus faibles.
I.5.3. Propriétés électriques
On dit qu’un corps est électriquement conducteur, si les électrons ou les ions libres dans ce corps permettent de circuler en assurant ainsi le transport du courant, au point du vue de leur structure. L’électronique est l’un des nombreux domaines d’application du verre, à cet effet les propriétés électriques du verre aux températures normale sont les plus souvent moins prépondérantes, tandis que les propriétés électriques aux températures élevées sont importantes.
La conductivité électrique des verres dépend essentiellement de la composition chimique, et elle est influencée par la composition chimique surtout en oxydes modificateurs. Les oxydes alcalins tels que Na2O, K2O, Li2O, augmentent la conductivité électrique, tandis que, les oxydes alcalino-terreux tels que CaO, BaO, B2O3, la diminuent.
I.5.4. Propriétés chimiques
Le verre est inattaquable chimiquement sauf par l’acide fluorhydrique, il existe parfois des réaction entre le verre et l’eau, par exemple en cas de stockage prolongé, verre en atmosphère humide, l’attaque de l’eau peut provoquer des phénomènes d’irisation puis de collage des verres .
SiO2+6 HF H2 ![]() [SiF6] + 2H2O (I.9)
[SiF6] + 2H2O (I.9)
I.5.5. Propriétés optiques
Bien que transparant, le verre est un matériau qui n’est pas traversé intégralement par l’énergie lumineuse, la lumière incidente est décomposée en réflexion et diffusion sur les faces, une autre partie est absorbée et se transforme en chaleur, la lumière restante est transmise.
Figure.I.6 : Décomposition de la lumière incidente à travers un échantillon en verre sodocalcique
1.5.5.1. Réfraction et réflexion
Quand un rayon lumineux passe d’un milieu 1 à un milieu 2, le changement de vitesse de propagation entraine la réfraction, c’est-a-dire le changement de direction du rayon. La réfraction obéit à la loi de Descartes .
n1 sin i1 = n2 sin i2 (I.10)
Où :
n1 et n2 sont les deux indices de réfraction. Les angles i1 et i2 que fait, dans les deux milieux, avec la normale à la surface de séparation et le rayon lumineux, sont appelés angles d’incidence et de réfraction (figure. I.7). Le milieu 2 est dit plus ou moins réfringent que le milieu 1, selon que le rayon se rapproche ou s’éloigne de la normale.
On appelle indice de refraction "n" d’un verre le rapport de la vitesse C0 de la lumière dans l’air à la vitesse C de la lumière dans ce verre.
Où :
i1 et i2 désignent l’angle du rayon lumineux avec la normale respectivement dans l’air et dans le verre, n est l’indice de réfraction du verre, C0 et C sont les vitesses des rayons lumineux respectivement dans l’air et dans le verre.
En générale Pour le verre de silice n = 1,459 et pour le verre sodocalcique n = 1,520
a) Influence de la composition sur l’indice de réfraction
Dans le verre de silice, il n’y a que des oxygènes pontants, lesquels possèdent une polarisation faible, de ce fait le verre de silice à un indice de réfraction relativement faible. L’introduction d’oxydes modificateurs fait augmenter l’indice car la polarisation des oxygènes non-pontants est plus grande que celle des oxygènes pontants. Plus le cation modificateur est petit, moins l’oxygène voisin est polarisé.
b) Influence de la température sur l’indice de réfractions
L’indice de réfraction se modifie avec la température, on constate une forte dimunition dans le domaine de transformation. La cause de cette diminution est le changement de structure du verre. Lorsqu’on refroidit un verre à grande vitesse, celui-ci présente alors à la température ambiante un indice de réfraction différent de celui d’un verre bien recuit, puisque l’indice de réfraction diminue dans le domaine de transformation, l’indice de réfraction des verres recuits trop rapidement est donc plus faible.
|
|
Figure. I.7 : Réfraction et réflexion d’un rayon lumineux à la surface de séparation de deux milieux transparents
I.5.5.2. Transmission
La transmission optique représente le passage d’une partie d’un faisceau à travers un échantillon (lame de verre), le faisceau lumineux subit plusieurs phénomènes tels que la transmission, la réflexion, la diffusion et l’absorption
La transmission de la lumiére est la propriété du verre la plus connue, et la plupart des emplois du verre dépendent de cette propriété. Le facteur de transmission est défini comme étant le rapport entre le flux lumineux transmis "I" et le flux incident "I0" à partir de la loi de BEER LAMBERT :
T= I /Iο exp(-α.x) (I.12)
Où :
I : Intensité lumineuse transmise
Iο : Intensité lumineuse incidente
α : Le coefficient linéaire d’absorption
x : L’épaisseur de l’échantillon.
La différence entre le flux transmis et le flux incident est due aux pertes par réflexion, diffusion et absorption ; cela est dû à la nature du verre, à son état de surface,…etc.
L’utilisation courante des verres d’oxydes est liée à leur bonne transmission dans la partie optique (UV, V, IR) du spectre. La figure (I.8) montre le spectre optique d’un verre plat ordinaire où l’on voit que la transmission dans le visible est proche de 90%.
| |
Figure I.8 : Spectre de transmission d’un verre plat commercial (épaisseur 1mm) .
a) Transmission dans l’ultraviolet (200nm - 400nm)
Pour les verres sans traces d’éléments colorants, L’absorption de la lumière dans l’ultraviolet est conditionnée par son interaction avec les ions oxygène du verre. Plus les ions O-2 sont faiblement liés, plus l’absorption est grande. Le verre de silice a une très bonne transmission dans l’ultraviolet grâce à ses oxygènes fortement liés. La transmission dépend aussi des faibles teneurs du verre en impuretés ou éléments colorants.
b)Transmission dans le visible (400nm-750nm)
Les verres contenant les modificateurs de réseau usuels (alcalins et alcalino-terreux) sont habituellement complètement incolores dans la région visible du spectre. Cela change si les verres contiennent en même temps des élement de transition. Il se produit pour ces élements des sauts d’électrons, c’est-à-dire des absorptions, même sous l’effet d’une lumière de faible énergie, si bien qu’il apparait des coloration dans le domaine visible. La couleur observée dépend tout d’abord de la configuration électronique et par conséquent de la nature de l’élement introduit .
c)Transmission dans l’infrarouge (750nm-1400nm)
La limite de transmission du coté des grandes longeurs d’onde se trouve au environ de 5µm, qui est une conséquence de la présence d’un fort pourcentage de SiO2. Des études ont révélées que la présence d’ion OH- affecte considérablement la transmission dans le spectre surtout à la bande de 2,8 µm. Il a été constaté qu’en fondant un mélange vitrifiable exempt d’eau, on obtenait un verre où l’absorption dans ce spectre est considérablement réduite.
|
|
Figure. I.9 : Spectre électromagnétique.
I.5.5.3. Absorption
L’absotrption est dû à l’interaction matière-lumière qui peut se produire dans certain cas :
► S’il existe dans un matériau des électrons libres, l’interaction est maximmale ; les matériaux de ce type sont complètement opaques à la lumière (cas des métaux).
► La lumière peut avoir une interaction avec d’autres électrons que les électrons libres. Dans ce cas, il faut une très grande énergie lumineuse, et par conséquent on retrouve dans le domaine de l’ultraviolet où le verre ordinaire devient complétement opaque. Il a été également montré que la température a une influence sur l’absorption du verre. Généralement le spectre d’absorption augmente avec la température .
I.5.5. 4. Diffusion
La diffusion est la dispersion du flux lumineux incident dans des différentes directions à la surfaes du verre, ce phénomène est dû à la nature du verre (diffusion moléculaire), la surface du verre (rugosité) et la réflexion multiple. La lumière diffusée sur les pare-brises de véhicules, causés par impact de petites particules impose une sécurité sévère pendant la conduite nocturne, elle augmente avec l’augmentation de la largeur et la profondeur de l’empreinte.
I.5.5. 5. Diffraction
On dit qu’il y a diffraction lorsque la lumière se propage en ligne droite ; après traversée d'une ouverture, cette onde plane ne se propage plus selon la même direction .Ce phénomène est dû à la nature ondulatoire de la lumière. Les phénomènes de diffraction ne se produisent que lorsque la lumière rencontre des trous ou des obstacles dont les dimensions sont de l’ordre de grandeur de la longueur d’onde.
Les rayonnements ne sont pas diffractés uniquement par des ouvertures. Un phénomène de diffraction se produit lorsqu’une onde passe entre deux objets séparés par une distance inférieure à la longueur d’onde du rayonnement. Par exemple, les rayons X sont généralement diffractés par les cristaux, leur longueur d'onde (de l'ordre de l'angström) étant de l'ordre de grandeur des distances interatomiques.
I.6. Caractérisation des matériaux par spectroscopie
La spectroscopie est une science qui utilise la lumière pour analyser les propriétés des atomes, des molécules et matériaux. La spectroscopie regroupe l’étude des phénomènes résultant de l’interaction des rayonnements électromagnétiques émis, absorbé, et de la matière. Elle repose sur deux concepts clefs :
● La nature et les propriétés de la lumière ;
● Les principes fondamentaux de la mécanique quantique et de ses applications pour décrire les atomes et molécules.
I.6.1. Spectroscopies dans l’UV et le Visible
La spectroscopie Ultraviolet-Visible est une technique de spectroscopie mettant en jeu les photons dont les longueurs d'onde sont dans le domaine des ultraviolet (200 nm – 400 nm), du visible (400 nm-750 nm). Les spectres dépendent essentiellement de la structure électronique des couches externes. Cette région est concernée par divers types de spectroscopies atomiques et moléculaires .
I.6.2. Spectroscopies dans l’IR
Le domaine infrarouge du spectre correspond aux radiations de nombre d’onde compris entre environ 12800 et 10 cm-1 ou des longueurs d’onde comprises entre 750 nm-1400 nm. Pour plus de facilité, on partage l’infrarouge en trois domaines : L’infrarouge proche, moyen et lointain (voir tableau ci-dessous) .
Tableau I.8 : Domaine du spectre infrarouge .
| Région | Domaine de longueurs d’onde/µm | Domaine de nombres d’onde/cm-1 | Domaine de fréquences/Hz |
| Proche | 0,78 – 2,5 | 12800 – 4000 | 3 ,8 1014 à 1,2 1014 |
| Moyen | 2,5 – 50 | 4000 – 200 | 1,2 1014 à 6,0 1012 |
| Lointain | 50 – 1000 | 200 – 10 | 6,0 1012 à 3,0 1011 |
| Le plus utilisé | 2,5 - 15 | 4000 - 670 | 1,2 1014 à 2,0 1013 |
I.6.3. Spectroscopie Raman
La spectroscopie non destructive permet de caractériser la composition moléculaire et la structure externe d'un matériau.
On focalise (avec une lentille) un faisceau de lumière monochromatique (un faisceau laser) sur l'échantillon à étudier et la lumière diffusée est analysée après avoir été recueillie par une autre lentille et envoyée dans un monochromateur permettant de mesurer son intensité via un détecteur. Plusieurs géométries de diffusion sont possibles. On collecte en général la lumière diffusée soit à 180°, soit à 90°.
La spectroscopie Raman et la micro spectroscopie Raman sont des méthodes non-destructive d'observation et caractérisation de la composition moléculaire et de la structure externe d'un matériau, qui exploite un phénomène physique qui est qu'un milieu modifie légèrement la fréquence de la lumière y circulant. Ce décalage en fréquence correspond à un échange d'énergie entre le rayon lumineux et le milieu et donne des informations sur le substrat lui-même. Les informations obtenues par la mesure et l'analyse de ce décalage permettent de remonter à certaines propriétés du milieu, par la spectroscopie
Figure. I. 10 : Principe de la spéctroscopie RAMAN.
I.7. Traitement des verres
Les contraintes résiduelles distribuées irrégulièrement et résultant d’un refroidissement non contrôlé, peuvent réduire la résistance mécanique des objets en verre. Dans certains cas, les contraintes sont si fortes qu’en présence de défauts convenables (en surface), il peut y avoir une destruction spontanée de l’objet. Pour minimiser à l’extrême ces contraintes, le verre subit dans la plupart des cas une opération de refroidissement lent appelé recuit ou recuisson.Il existe d’autres traitements du verre à savoir :
i) La trempe thermique, ii) La trempe chimique.
I.7.1. Recuit
Le recuit est un traitement thermique appliqué au verre dans le but de supprimer les contraintes et les tensions qui empêcheraient le découpage lors du refroidissement.Ce traitement consiste à maintenir le verre pendant un temps plus ou moins long selon l’épaisseur de l’échantillon, à une température légèrement inférieure à la température de transition (Tg), puis à le refroidir lentement suivant une vitesse défini par les qualités qu’on veut obtenir .
I.7.2. Trempe thermique
Le principe de la méthode consiste, à chauffer l’objet en verre jusqu’à une température voisine de son point de ramollissement, puis à le sortir du four et à la refroidir rapidement avec des jets d’air comprimé. Dans ces conditions, les couches internes (cœur) sont encore visqueuses alors que les couches externes se figent. Lorsque l’objet est finalement refroidi à la température ambiante, le cœur plus chaut doit se contracter plus que l’enveloppe. Cette différence de contraction conduit à l’apparition des contraintes de compression dans les couches voisines de la surface, équilibrées par les contraintes d’extension des couches internes. Donc on aura un système équilibré de contraintes. L’intensité des contraintes développées dépend: i) du coefficient de dilatation linéaire, ii) de la vitesse de refroidissement.
Figure.I.11 : Répartition des contraintes dans une feuille de verre trempé
thermiquement.
I.7.3. Trempe chimique
La trempe chimique est la technique la plus commode et la plus employée .Ce procédé de renforcement du verre consiste à modifier (diminuer) le coefficient de dilatation thermique des couches superficielles. Ceci se produit en modifiant la nature chimique de la surface. Plusieurs possibilités sont offertes.
I.7.3.1. Echange ionique
L’échange ionique est la base du renforcement du verre par la trempe chimique, dans ce cas, le renfort ne provient plus de la mise en compression de la surface au moyen du coefficient de dilatation [9]. Ce procédé consiste à immerger le verre dans un bain de sels fondus à une température inférieur à celle de relâchement de contraintes (500 à 550°C pour les verres sodocalciques). Cette immersion provoque des échanges ioniques superficiels : les cations alcalins du verre diffusent depuis la surface vers le bain et sont remplacés par les cations du sel fondu qui cheminent en sens inverse. Pour utiliser cette technique deux variantes sont possibles :
a) Echange au- dessus de Tg
On remplace un cation du verre par un cation de rayon ionique plus faible, par exemple Na+ (r= 0.98Å) est remplacé par Li+ (r= 0.78Å). Cette opération doit être conduite à une température supérieure à Tg pour permettre le fluage, c’est-à-dire, une relaxation complète des contraintes à la température de traitement. Au refroidissement il y a mise en compression des couches superficielles.
b) Echange au- dessous de Tg
On remplace un cation du verre par un cation de rayon ionique plus élevé. Par exemple, Na+ (r= 0.98Å) est remplacé par K+ (r= 1.33Å) provenant d’un bain fondu de nitrate de potassium [24]. La trempe chimique conduit à un profil de contraintes très différent de la trempe thermique. Cette technique présente néanmoins un certain avantage :
La contrainte de compression obtenue peut être très élevée puisque l’échange s’effectue sur le verre quasiment rigide (T < Tg) (dans le cas des ions plus élevés), la méthode ne comporte pas de risque de déformation de verre. Elle s’applique aussi aux verres très minces et difficiles à tremper thermiquement. Car le coût est très élevé . C’est la raison pour la quelle cette méthode est limité aux produits de haute technologie, notamment dans le domaine aérospatiale tel que le pare-brise de l’airbus.
On peut l’utiliser la trempe chimique pour traiter des produits de n’importe quelle forme, d’épaisseur inférieure à 2 mm, et même sur des verres avec se très faibles coefficient de dilatation. Par ailleurs, ces traitements chimiques se font à des températures au dessous de Tg. Ceci réduit les problèmes associés à la déformation visqueuse des verres traités.
L’inconvénient de la trempe chimique est le temps nécessaire pour effectuer l’échange (de quelques heures à quelque dizaines d’heures). Pour le réduire ou accélérer les échanges, on joue sur la composition du verre. Un ajout d’alumine permet d’augmenter sensiblement les coefficients de diffusion au cours des échanges et permet d’obtenir des profondeurs sensiblement suffisantes pour des durées de traitement raisonnables.
1.7.3.2. Influence des paramètres de traitement
a) Effet de la température et du temps de maintien
L’échange ionique est un procédé de diffusion contrôlé. Il dépend du temps, de la température et des additifs d’activation. Par conséquent, plus haute est la température de traitement ; plus court sera le temps requis pour former une couche ’contrainte’ d’épaisseur donnée. La température supérieure est limitée par le risque de la relaxation des contraintes . Ainsi si l’échange ionique est réalise prés de Tg (ou > Tg), les contraintes générées par le processus sont rapidement dissipées ou éliminées par le flux visqueux du verre. Pour une composition de verre donnée, l’augmentation de la résistance atteinte par l’échange ionique dépend des conditions du traitement.
Figure.I.12. Echange ionique d’ions Na+ par des ions K+ contenue dans un sel fondu.
samedi 2 août 2014
Transformation et phénomène de transport de la matière
TRANSFORMATION ET PHÉNOMÈNES DE TRANSPORT DE LA MATIÈRE
IIA. Transformation de la matière
IIA.1.Introduction
La matière peut subir soit des transformations physiques suite aux modifications des forces de cohésion (solidification, ébullition, condensation et sublimation), soit des transformations chimiques ou transformation de la matière : il s’agit des réactions chimiques.
IIA.2. Réaction chimique
IIA.2. 1.Généralités
La réaction chimique est le phénomène qui se produit lorsque des composés chimiques sont mis en contact et se transforment en des composés différents.
Pour qu’une réaction chimique se produise entre deux corps, il faut que ceux-ci aient une affinité l’un pour l’autre. Il existe en effet plusieurs possibilités dans l’évolution d’un système chimique :
1) système stable – les corps ne réagissent pas du tout l’un sur l’autre (exemple : anhydride carbonique – eau);
2) système instable – la réaction entre les deux corps est spontanée dès qu’ils entrent en contact (exemple : eau oxygénée – permanganate de potassium);
3) système métastable (état de faux équilibre) – il faut amorcer la réaction; c’est la thermodynamique qui, en précisant l’instabilité relative de l’état ou gagné une charge négative (anion). Ces ions peuvent résulter de la coupure (scission hétérolytique) d’une liaison chimique. Un deuxième type d’intermédiaire actif des réactions chimiques est constitué par les radicaux ou les atomes. Ceux-ci peuvent être engendrés par la scission homolytique de certaines liaisons. Enfin, l’état d’activation dans une réaction chimique peut être apporté par un complexe, lequel peut se former avec des ions.
Beaucoup de réactions catalysées par les acides et les bases sont expliquées par la fixation d’un proton ou d’un ion hydroxyle sur le réactif.
IIA.2.2. Thermodynamique chimique
La thermodynamique chimique définit ce que l’on appelle le potentiel chimique, qui caractérise chaque système chimique et que l’on peut comparer à un potentiel de gravité. En d’autres termes, un système chimique est instable par rapport aux systèmes dont le potentiel chimique est inférieur au sien. Ce potentiel varie de façon à peu près linéaire avec la température, mais la pente de ces variations varie avec les systèmes. On peut tracer des courbes potentiel chimique – température lesquelles permettent de prévoir dans quel domaine de température un système chimique est stable par rapport à un autre, et par conséquent de prévoir la possibilité d’une réaction.
L’écriture des relations stœchiométriques ne nous apprend rien sur la faisabilité des réactions qu’elles sont censées représenter. Pour savoir si une réaction, décrite par une relation stœchiométrique, est possible, il
faut avoir recours à la thermodynamique et plus particulièrement aux données d’enthalpie libre G ou énergie libre de Gibbs.
L’énergie libre G est la fonction d’état qui regroupe les paramètres enthalpie et entropie, à savoir :
G = H – TkS (IIA.1)
Elle reflète en quelque sorte la réserve de travail utile disponible dans un système à température et pression constantes.
Il est démontré que pour assister à une réaction spontanée à température et pression constantes, il faut que son ΔGr en kJ/mol soit négatif, c’est-à dire que tout système tend à évoluer vers le minimum de son énergie
libre de Gibbs.
Il a été établi que :
ΔGr = ΔHr – TKΔSr (IIA.2)
Le ΔGr d’une réaction peut ainsi se calculer à partir du ΔHr et du ΔSr de celle-ci.
Remarques
L’exigence d’un ΔGr négatif implique que le cas le plus favorable pour obtenir une réaction complète se trouve réalisé lorsque le ΔHr présente une valeur élevée négative et lorsque le ΔSr présente une valeur élevée positive.
On retrouve ainsi la vérification thermodynamique du principe de Bertholet et de la règle de Matignon.
Lorsque les deux fonctions H et S présentent des valeurs telles (ΔHr positive et ΔSr négative) qu’elles rendent le ΔGr positif, la réaction chimique est pratiquement impossible. C’est la réaction inverse (produits → réactifs) qui serait spontanée.
Dans les cas où les deux termes jouent de façon contradictoire tout en permettant à ΔGr d’être négatif. On a affaire à des réactions équilibrées (exothermiques ou endothermiques), l’équilibre sera atteint lorsque la fonction ΔHr compensera exactement le terme entropique TKΔSr, c’est-à-dire quand ΔGr = 0.
Pour n’importe quelle réaction chimique caractérisée par un équilibre, par exemple :
on a :
Avec : la constante d’équilibre, aA l’activité du réactif A, aB l’activité du réactif B, et aC l’activité du produit C.
Cette constante est définie par le rapport entre le produit des activités des
« produits » et le produit des activités des « réactifs », chacune de celles-ci étant élevée à la puissance du coefficient stoechiométrique concerné.
On démontre que :
ΔGr = ΔGr° + RTK lnQ (IIA.4)
où ΔGr° est la différence entre les enthalpies libres standard de formation des produits purs et celles des réactifs purs; ΔGr l’enthalpie libre de réaction pour une composition définie du mélange réactionnel.
Q étant le quotient réactionnel, c’est-à-dire un rapport qui a exactement la même forme algébrique que l’expression de la constante d’équilibre mais où interviennent les activités des diverses espèces en présence à tout moment au cours de l’évolution du système vers son état d’équilibre.
À l’équilibre, ΔGr = 0 et Q = Keq, d’où :
ΔGr° = – RTK lnKeq (IIA.5)
Ou encore :
Keq = exp(– ΔGr°/RTK) (IIA.6)
Une réaction sera d’autant plus favorisée que la diminution d’enthalpie libre qui l’accompagne sera plus élevée.
IIA.2.3 Cinétique chimique
Si la thermodynamique apporte des informations précieuses sur les possibilités de transformation d’espèces chimiques en d’autres espèces ainsi que sur les énergies mises en jeu, elle n’éclaire en rien les différents phénomènes qui interviennent au cours de ces transformations, ni les interventions que l’on peut faire sur le déroulement de ces phénomènes. Cet aspect de la connaissance des réactions chimiques, d’une grande importance théorique et pratique, est l’objet de la cinétique chimique.
La cinétique chimique traite de l’influence de différents facteurs physiques (température, pression, concentration) sur la vitesse des réactions. Celle-ci est mesurée par la variation, en fonction du temps, de la concentration des espèces chimiques intervenant dans la réaction. Si le système est ouvert en régime permanent, on peut considérer qu’il s’agit de la mesure d’un débit spécifique de transformation chimique.
IIA.2.3.1.Vitesse de réaction
Cette notion qui représente une donnée industrielle extrêmement importante exprime la quantité de substance que l’on peut obtenir en unité de temps. La vitesse de réaction dépend de trois facteurs essentiels qui sont les concentrations, la température et les catalyseurs.
Si dans un équilibre :
αA +βB ←→γC +δD
– dnA et – dnB moles de A et de B, disparaissent dans le temps dt, cependant que se forment dnC et dnD moles de C et de D, les variations de concentration sont définies par la relation :
dans laquelle λ est le degré de progression de la réaction.
On définit alors la vitesse de réaction par :
wr =dλ /dt (IIA.8)
La vitesse d’une réaction chimique mesure le débit spécifique de transformation chimique, c’est-à-dire la quantité de matière transformée par unité de temps, quantité rapportée à une unité d’extensité qui dépend du
problème traité : volume, masse, surface.
La quantité de matière transformée est mesurée le plus souvent en nombre de moles par unité de temps, ou en masse par unité de temps. Dans ce chapitre, nous adopterons la première convention : mesure par un débit molaire.
Facteurs susceptibles de modifier les vitesses des réactions :
ü la concentration des réactifs en solution : en général, une réaction est d’autant plus rapide que la concentration des réactifs est plus élevée ;
ü la pression des réactifs gazeux : les fortes pressions ont pour effet de comprimer les gaz et donc d’augmenter leur concentration ;
ü la surface active des solides : le fait de broyer un solide en petites particules augmente la surface pouvant être en contact avec le liquide ou le gaz environnant ;
ü la température : le fait d’élever la température augmente la proportion des atomes, molécules ou ions dotés d’une énergie suffisante pour réagir efficacement lors de leurs collisions ;
ü les catalyseurs : qu’il s’agisse de catalyse homogène ou hétérogène, l’ajout d’un catalyseur ouvre la voie à un autre mécanisme réactionnel caractérisé par une énergie d’activation plus faible ;
ü l’irradiation : certains rayonnements électromagnétiques peuvent amorcer des réactions radicalaires en chaîne, lesquelles sont d’autant plus rapides que le rayonnement est intense.
IIA.2.3.2.Inertie cinétique
Terme signifiant qu’une réaction n’a pas lieu, même s’il apparaît qu’elle soit faisable. Aucune transformation ne semble se produire parce que la vitesse de la réaction est trop lente pour qu’on puisse remarquer quelque chose. Il existe une barrière qui bloque la réaction, habituellement une énergie d’activation élevée. Le composé ou le mélange est inerte. Voici quelques exemples d’inertie cinétique :
ü un mélange de méthane (gaz naturel) et d’oxygène à la température ordinaire ;
ü un mélange de CCl4 et d’eau à la température ordinaire ;
ü une solution de peroxyde d’hydrogène en l’absence de catalyseur ;
ü de l’aluminium métallique dans de l’acide chlorhydrique dilué.
Rien ne se passe avec ces mélanges, même si les réactions possibles pourraient bel et bien avoir lieu.
On emploie souvent le terme « stabilité chimique » à la place de « inertie cinétique ». Il permet, en tout cas, de faire une distinction nette entre deux types tout à fait différents d’explication. Pour bien se faire comprendre,
les chimistes qualifient de :
ü « stables » les systèmes qui ne manifestent aucune tendance à réagir ;
ü « inertes » les systèmes qui devraient réagir, mais qui ne le font pas
pour une raison de vitesse (aspect cinétique).
IIA.2.4. Constante de vitesse
L’étude systématique de nombreux cas de réactions lentes a conduit Van’t Hoff à proposer la relation générale :
wr =kv(CA)α (CB)β (IIA.9)
Où la constante de proportionnalité kv est dite constante de vitesse.
Si la réaction est réversible on aura :
wr =kv’(CC)α (CD)β (IIA.10)
Dans une équation équilibrée, le rapport Keq =kv /kv’ est nécessairement une constante, que l’on appelle constante d’équilibre.
La constante d’équilibre d’une réaction élémentaire est égale au rapport des constantes de vitesse de la réaction et de la réaction inverse.
Dans la grande majorité des cas, la vitesse des réactions chimiques croît avec la température. C’est Arrhenius qui a établi la relation très générale reliant la vitesse de réaction à la température :
kv =ko exp(– Ea /RTK) (IIA.11)
où :
•kv est la constante de vitesse (en s– 1);
•Ea l’énergie d’activation (kJ/mol);
•R la constante des gaz parfaits;
•TK la température absolue;
•ko le facteur de fréquence dépendant de la géométrie des molécules.
L’existence d’un facteur exponentiel met en évidence la grande influence de la température sur la vitesse de réaction.
L’équation d’Arrhenius a été ensuite améliorée par Eyring dans ses travaux du développement de la théorie de transition (théorie du complexe activé), dans laquelle la constante de vitesse est déterminée pour la
décomposition d’un complexe dans un état activé et s’écrit :
kv =(k/h) TK exp(– ∆G* /RTK) (IIA.12)
avec ∆G* l’enthalpie libre d’activation, égale à Ea à quelques unités de RTK prés; k la constante de Boltzmann; h la constante de Planck.
Eyring dessine un profil énergétique (la surface de potentiel) qui relie les réactifs aux produits; il suppose que les molécules devront franchir un col pour parvenir de l’état des réactifs à l’état des produits.
La vitesse d’une réaction chimique dépend, comme cela a été dit, de la concentration des différents produits en présence; elle est proportionnelle aux concentrations des différentes espèces en présence, chacune affectée de son exposant respectif m, n… On appelle ordre global expérimental de la réaction la somme des exposants m +n +… Les exposants m, n… peuvent être égaux ou différents des coefficients α, β … dont la somme est appelée ordre théorique de la réaction. Généralement, l’ordre théorique est différent de l’ordre expérimental lorsque la réaction se déroule en plusieurs étages.
IIA.2.4. Énergie d’activation
Pour que la réaction se produise, le système doit donc disposer d’une énergie supplémentaire pour activer les molécules. Le supplément Ea d’énergie ainsi demandé s’appelle l’énergie d’activation.
Le maximum de la courbe de la (figure IIA.1) correspond à un état que l’on nomme état de transition ou complexe activé. Il ne constitue pas un intermédiaire observable, car sa durée de vie est, par définition, nulle. À partir de cet état de transition, le système peut aussi bien régresser que progresser, son énergie potentielle diminuant dans les deux cas.
Figure IIA.1 – Évolution de la réaction en fonction de l’énergie d’activation.
Une réaction chimique entre deux composés A et B peut s’écrire :
A +B A.B C + D
(1) (2)
Le signe traduisant le fait que la réaction peut évoluer dans le sens(1) (2) aussi bien que dans le sens (2) (1). A.B correspond à un maximum d’énergie potentielle et indique l’état de transition des réactifs.
La position de l’équilibre dépend de la différence ∆Er entre les niveaux énergétiques correspondant à l’état initial et à l’état final. Selon le cas (figure IIA.2), on peut avoir des réactions exothermiques (∆Er négatif), endothermiques (∆Er positif) ou athermiques (∆Er = 0).
Figure IIA.2 – Avancement de la réaction en fonction de ∆Er.
La description détaillée d’une réaction chimique, avec tous ses états de transition et ses intermédiaires, constitue le mécanisme réactionnel.
L’établissement d’un mécanisme réactionnel repose sur :
– une simplicité des réactions élémentaires, qui conduit à des étapes dont la molécularité est la plus faible possible;
– le minimum de changements de structure à chaque étape, car la probabilité de rupture de plusieurs liaisons en même temps est faible;
– la réversibilité macroscopique (l’expérience enseigne que le chemin suivi par une réaction élémentaire dans un sens est le même que celui qui est suivi dans le sens opposé).
En ce qui concerne l’énergie d’activation Ea, plus elle est élevée et plus la réaction est difficile à réaliser, c’est-à-dire lente. En d’autres termes, il est nécessaire de fournir plus d’énergie pour permettre aux molécules de franchir la barrière énergétique Ea.
Cette énergie est fournie classiquement par chauffage du milieu (réactions thermiques). On peut l’abaisser en ajoutant une substance appropriée (catalyseur) qui permet de suivre un autre trajet réactionnel de plus
faible énergie d’activation.
Les chimistes et les ingénieurs en génie chimique disposent donc aujourd’hui de possibilités de prévision des réactions chimiques, ainsi que de nombreux moyens qui leur permettent d’agir sur ces réactions, de les contrôler et les orienter. La mise en œuvre de ces moyens devient de plus en plus efficace, grâce en particulier aux progrès spectaculaires qui sont actuellement réalisés dans la connaissance des mécanismes réactionnels comme dans la compréhension du mode d’action des catalyseurs et de nombreux
autres facteurs (par exemple la nature des solvants) qui interviennent dans le déroulement des réactions chimiques.
La plupart des réactions chimiques étant réversibles, elles s’arrêtent en apparence à un moment où les constituants du système initial et du système final subsistent en présence les uns des autres, sans que leurs
concentrations respectives varient. Il y a alors équilibre chimique. Pour une réaction donnée, s’effectuant avec une certaine vitesse, l’équilibre est atteint si la réaction inverse s’effectue à la même vitesse.
Dans la pratique, on peut favoriser la production d’un composé issu d’une réaction équilibrée, en éliminant celui-ci au fur et à mesure de sa formation ou en éliminant le coproduit de la réaction.
Il est relativement rare, surtout en chimie organique, qu’une réaction se produise seule et ne conduise qu’au produit que l’on désire obtenir. Très souvent, la réaction principale est accompagnée de réactions secondaires qui se déroulent simultanément, en consommant une partie plus ou moins importante du réactif de départ et en diminuant le rendement en produit désiré. C’est le plus souvent l’emploi de catalyseurs sélectifs qui permet d’augmenter la vitesse de formation de la réaction principale.
IIA.2.5.Catalyse.
Le terme catalyse (introduit par Berzelius) désigne le phénomène par lequel la vitesse des réactions chimiques peut être modifiée en la présence de certaines petites quantités de substance appelées catalyseurs. En abaissant l’énergie de l’état de transition, le catalyseur fournira à l’ensemble des réactifs un chemin énergétique plus économique, tout en conduisant aux mêmes produits finaux. L’espèce chimique qui détermine ce phénomène n’apparaît pas dans l’équation bilan de la réaction ; il y a donc une association temporaire du catalyseur avec un ou plusieurs réactifs.
Puisque le catalyseur n’est pas consommé pendant la réaction, même s’il a subi des modifications provisoires, une faible quantité de catalyseur par rapport aux réactifs en présence doit, en règle générale, permettre la transformation d’une très grande quantité de réactif. On estime que 80 % au moins des procédés utilisent des catalyseurs pour accélérer les réactions et les rendre plus sélectives.
Suivant que le catalyseur est soluble ou non dans le milieu réactionnel, on parle de catalyse homogène ou de catalyse hétérogène. Si le catalyseur est une enzyme, il est question de catalyse enzymatique. La catalyse homogène a généralement lieu en phase liquide (par exemple l’estérification d’un acide carboxylique par un alcool est catalysée par un acide fort, sulfurique ou paratoluène sulfonique). Dans certains cas, une accélération de la réaction n’est pas souhaitable. On cherche au contraire à la freiner pour éviter une oxydation ou une décomposition trop rapide, par exemple.
On parle alors d’une catalyse négative lors de laquelle le catalyseur, appelé alors inhibiteur ou stabilisateur, provoque un mécanisme de réaction dont l’énergie d’activation est nettement augmentée par rapport à celle de la réaction non inhibée.
IIA.2.5.1. Produits obtenus
Soit la réaction de décomposition thermique du carbonate de calcium
dans les fours à chaux :
CaCO3 ←→CaO + CO2
Dans le cas où le produit recherché est la chaux (CaO), le dioxyde de carbone est un coproduit puisque sa formation est nécessairement associée à celle de la chaux. Le rapport, lié à la stoechiométrie, des quantités molaires de chaux et de dioxyde de carbone formés est 1. La notion de coproduit est très importante car l’existence d’un coproduit nécessite obligatoirement l’étude de sa valorisation, s’il ne s’agit pas d’une substance banale telle que l’eau.
Soit maintenant l’équation générale de transformation des réactifs A1, A2, … en produits C1 (produit recherché), C2 (coproduit), … avec ni(A1), ni(A2)… les nombres de moles de A1, A2,. à l’instant initial (ni(C1) étant égal à 0), et nf(A1), nf(A2), nf(C1), nf(Cz) … les nombres de moles de A1, A2, … C1, C2 … à la fin de la réaction :
A1 + A2 + … ←→C1 + C2 +…
Afin de définir la qualité d’un procédé, il est nécessaire de connaître les définitions suivantes :
IIA.2.5.2. Taux de conversion
Le taux de conversion représente le pourcentage d’un réactif transformé par rapport à la quantité initiale de ce réactif.
IIA.2.5.3. Sélectivité (par rapport au réactif Ai)
La sélectivité correspond au pourcentage de moles formées du produit recherché par rapport à la quantité de moles transformées du réactif considéré. et
sont les coefficients stochiométriques du produit et du réactif.
IIA.2.5.4. Rendement
Le rendement donne le pourcentage de moles d’un produit recherché C1 par rapport au réactif considéré Ai.
IIA.3. Les grands types de réaction chimique
Il est possible de classer les réactions chimiques en fonction des réactifs et des produits qu’elles mettent en œuvre.
Ø Combinaisons directes
Il s’agit de combinaisons directes d’éléments, combinaisons directes d’éléments avec des composés, ou encore combinaisons directes de composés entre eux.
C’est le cas, par exemple, de l’action du chlore sur l’éthylène qui fournit un nouveau composé, le dichloro-éthane :
Ø Décompositions
Il s’agit des transformations de composés en composés plus simples. Un exemple est donné par la décomposition du carbonate de calcium en chaux et en gaz carbonique :
Ø Substitutions
Cas dans lequel une fonction chimique, un atome ou un groupe d’atomes d’une entité moléculaire, prend la place d’un autre atome ou groupe dans un composé.
Exemple9
Ø Doubles décompositions
Deux composés, en réagissant l’un sur l’autre, fournissent deux autres composés.
Exemple
Le chlorure de baryum réagit en solution aqueuse sur l’acide sulfurique et donne le sulfate de baryum et l’acide chlorhydrique.
Ø Polymérisations
Il s’agit de la formation à partir de molécules de masse moléculaire faible, de composés à masse moléculaire élevée (macromolécules) provenant de la jonction d’unités structurales de base appelées monomères.
Pour de grandes valeurs de n (nombre d’unités) on parle d’une macromolécule dite polymère. On distingue deux types de polymérisation : les polyadditions, dans lesquelles des monomères insaturés s’additionnent les uns aux autres, et les polycondensations, où les monomères se lient les uns aux autres en éliminant une petite molécule (le plus souvent de l’eau).
Exemple
Polymérisation de l’éthylène en polyéthylène :
avec n variant de 500 à 1000.
Un polymère constitué d’un mélange de monomères différents est appelécopolymère (la vinylite est un copolymère obtenu à partir de chlorure et d’acétate de vinyle).
Ø Oxydoréductions
Ce sont les réactions inversables dans lesquelles des transferts d’électrons font passer un élément à un degré d’oxydation inférieur par gain d’électrons, alors que simultanément un autre élément s’oxyde en perdant
des électrons : l’agent réducteur (qui s’oxyde) libère des électrons qui sont captés par l’agent oxydant (qui, évidemment, se réduit).
Exemple
L’étain passe du degré d’oxydation II dans SnCl2 à IV dans SnCl4, pendant que le mercure est réduit du degré d’oxydation II dans HgCl2 à I dans Hg2Cl2
I.4. Les procédés chimiques unitaires
Une opération chimique unitaire implique l’existence d’une réaction chimique conduisant à l’introduction ou l’élimination d’un élément tel que l’hydrogène, l’oxygène ou le chlore, ou d’un groupe tel qu’un groupe alkyle CxHy, un groupe nitro NO2, ou un groupe hydroxyle.
Ø Aldolisation
Réaction d’addition d’une molécule d’aldéhyde à une autre molécule d’aldéhyde, identique ou différente, conduisant à un aldéhyde-alcool.
Ø Aromatisation
Transformation des hydrocarbures saturés (alcanes, cyclanes) en hydrocarbures aromatiques (c’est-à-dire à noyaux benzéniques séparés ou accolés). C’est la réaction principale du reformage catalytique.
Ø Carbonylation
L’introduction du groupe carbonyle (CO) au sein d’une molécule conduit à des acides carboxyliques, par l’action simultanée de l’eau et
du monoxyde de carbone.
On a :
R2- C= C- R4 + H2O + CO ![]() R2- CH= C - C – COOH
R2- CH= C - C – COOH
R1 R3 R3 R4
Ce procédé chimique unitaire permet aussi la synthèse d’aldéhydes, de cétones, d’anhydrides, d’isocyanates (ArN = C = O), et d’amides (R – CO – NH2).
Ø Décarbonatation
La séparation du dioxyde de carbone, qui est un acide, d’un milieu liquide ou gazeux définit la décarbonatation. Cette séparation s’effectue généralement par voie chimique par réaction des composés basiques, tels que les mono-, di- ou triéthanolamines et le carbonate de potassium ou par voie physique en utilisant des solvants de gaz acides tels que le méthanol, le carbonate de propylène et le 1.méthyl-2.pyrrolidone.
Ø Électrolyse
Procédé physique qui, par passage d’un courant électrique continu dans un milieu fluide, permet des échanges d’électrons. L’électrolyse correspond à un processus d’oxydoréduction : la cession des électrons de la cathode aux ions correspond à une réduction, alors que le transfert des électrons des ions à l’anode est une oxydation. Le mouvement des ions, à cause de la différence de potentiel, et leur neutralisation aux électrodes
expliquent le passage des électrons de la cathode à l’anode et, par conséquent, le passage du courant électrique dans la solution. On l’utilise pour la préparation de dérivés minéraux et métallurgiques importants tels que le chlore, la soude et l’aluminium.
Ø Estérification
On prépare les esters par l’action d’un alcool sur un acide :
R – COOH + R’OH R – COOR’ + H2O
Cette réaction (équilibrée) d’estérification est limitée par la réaction inverse d’hydrolyse de l’ester formé. Pour rendre complète la formation d’ester, on remplace l’acide par son anhydride :
(R – CO)2O + R’OH ![]() R – COOR’ + R – COOH
R – COOR’ + R – COOH
Ø Fermentation
C’est une transformation biochimique provoquée par l’action de microorganismes et de leurs enzymes. Certains produits chimiques tels que les acides citrique, gluconique et itaconique sont produits uniquement par fermentation.
Ø Réaction de Friedel-Crafts
Le benzène réagit sur les halogénures d’alkyle R – X et avec les chlorures d’acyle R – CO – Cl, en présence de AlCl3 pour donner des alkylbenzènes et des acylbenzènes :
On nomme les esters du nom de l’acide correspondant; ainsi le produit
d’estérification de l’acide acétique par l’alcool éthylique est l’acétate d’éthyle.
Ø Gazéification
Procédé qui permet la production d’un gaz combustible ou d’un gaz de synthèse à partir de produits contenant du carbone qui peuvent être liquides (les huiles) ou solides (le charbon). Le gaz ainsi obtenu s’appelle gaz naturel de substitution (SNG).
Ø Hydrogénation
L’hydrogénation est un procédé chimique unitaire qui conduit à l’addition d’hydrogène à différents composés. C’est le cas en pétrochimie de tous les procédés d’hydrotraitement tels que l’hydrocraquage et l’hydrodésulfuration.
L’hydroformylation correspond aussi à une hydrogénation.
Une autre réaction d’importance industrielle est la synthèse d’alkylaluminiums par réaction de l’Al avec une -oléfine et de l’hydrogène.
Exemple
Synthèse du triéthylaluminium :
3 CH2 = CH2 + 3/2 H2 + Al Al(C2H5)3
Naturellement, l’hydrogène est utilisé en grande quantité pour produire, par exemple, l’ammoniac. Il est aussi employé pour produire à haute température certains métaux exempts de carbone à partir de leurs
oxydes.
Exemple
Réaction d’addition d’hydrogène moléculaire (H2) sur un composé insaturé :
Cr2O3 + 3H2 ![]() 2Cr + 3H2O
2Cr + 3H2O
Un catalyseur est nécessaire pour accélérer ce processus :
= C = R + H2 = CH– R– H
Quelques exemples de réactions d’hydrogénation importantes sont :
– L’hydrogénation des alcynes en alcènes et alcanes (les catalyseurs les plus courants sont des métaux divisés comme le nickel, le palladium,
le platine) :
– C ≡C – ![]() – CH=CH –
– CH=CH – ![]() – CH/H – CH/H –
– CH/H – CH/H –
– L’hydrogénation catalytique des cétones et aldéhydes en alcools.
L’hydrogénation, qui est une réaction d’addition, se distingue de l’hydrogénalyse au cours de laquelle il y a rupture d’une liaison par hydrogène :
Ø Hydrolyse
C’est la décomposition d’une substance chimique, suite à la réaction d’une molécule ou d’un ion avec une molécule d’eau, au cours de laquelle une liaison de la molécule d’eau se trouve rompue. Dans le cas
des solutions aqueuses d’électrolytes, ce terme s’applique aux réactions des cations (ions positifs) et des anions (ions négatifs) avec l’eau pour produire des acides faibles.
Ø Nitration
C’est la substitution d’un atome d’hydrogène ou d’un autre atome ou groupe d’atomes par un groupe nitré NO2. Les principaux produits obtenus par la nitration sont le nitrobenzène, l’aniline et le toluène-diisocyanate (TDI). La nitration du benzène est réalisée avec un mélange nitrant composé
de 40 % d’acide nitrique, 40 % d’acide sulfurique et 20 % d’eau. On a :
Ø Oxydation
Toute augmentation, en valeur algébrique, du degré d’oxydation est une oxydation. Ce transfert d’électrons peut se faire par voie chimique ou électrochimique.
On a par exemple :
Ø Solvatation
C’est le procédé qui correspond à la formation d’une entité chimique entre un ion ou une molécule en solution et les molécules du solvant.
L’extraction liquide – liquide (à l’aide d’agents solvatants) et la distillation extractive (mettant en oeuvre un solvant différentiant la volatilité de corps à point d’ébullition voisins) sont des procédés de séparation dont le principe repose sur la solvatation.
Ø Vapocraquage
Procédé industriel de production d’oléfines et d’hydrocarbures aromatiques par craquage thermique d’hydrocarbures (éthane, naphta et gazole principalement) en présence de vapeur d’eau.
Ø Vaporeformage
Procédé industriel d’oxydation ménagée des hydrocarbures par l’eau produisant un mélange essentiellement formé d’hydrogène et de monoxyde de carbone. Ce mélange gazeux est utilisé pour la fabrication de l’hydrogène, de l’ammoniac et du méthanol.
PHÉNOMÈNES DE TRANSPORT
IIB.1 Considérations générales
Présent dans tous les domaines de la science et en ingénierie, le phénomène de transport (ou phénomène de transfert) est un processus irréversible durant lequel une grandeur physique est transportée par le biais de molécules.
Tous les phénomènes de transport ont pour origine l’inhomogénéité d’une grandeur intensive. L’étude de chaque phénomène de transport se réfère à une certaine entité (caractéristique) transférée. Le moment,
l’impulse ou la quantité de mouvement nécessaire pour augmenter la vitesse d’un fluide, la chaleur afin de vaporiser un liquide, la masse du liquide transportée dans une conduite ou celle des vapeurs diffusant dans un gaz constituent des exemples d’entités transportables dans les procédés de génie chimique. Il est donc nécessaire que l’entité transférée soit accumulée ou soit débitée en continu (toujours par un processus de
transfert) vers le point initial du transport.
L’entité transférée est transportée par les porteurs de charge, lesquels ont la capacité de prendre en charge une certaine quantité à transporter, la faire déplacer et la décharger au point final du transport ou vers un point intermédiaire situé en chemin. Dans les procédés utilisés par l’ingénierie chimique on trouve les types de porteurs suivants :
1. porteurs de type radiant : (ou photons quanta d’énergie électromagnétique);
2. porteurs de type par diffusion : molécules, atomes, ions, électrons ;
3. porteurs de type par convection : associations de molécules, volume fini de liquide, tourbillon.
Parmi les propriétés caractéristiques présentées par les porteurs on s’intéresse à :
– la grandeur de la charge transportée par chaque porteur ;
– le flux des porteurs (débit par unité de surface) ;
– la mobilité des porteurs (vitesse momentanée et vitesse moyenne) ;
– le libre parcours moyen, étant donné que le mouvement des porteurs ne représente que de segments du chemin à parcourir.
Le transport de l’entité transféré ou de la caractéristique devient possible uniquement s’il y a une chute d’énergie disponible d’un niveau plus haut vers un niveau plus bas, c’est-à-dire lorsque le transport est accompagné par une chute de potentiel, dont le gradient détermine la vitesse du transport en chaque point.
La différence de potentiel, appelée aussi grandeur agissante, ou – improprement
– force motrice, caractérise chaque type de transport, par exemple :
· différence de tension pour le transport de l’électricité ;
· différence de pression pour le transport hydraulique ou pneumatique;
· différence de vitesse pour le transport de moment ;
· différence de température pour le transfert thermique ;
· différence de concentration pour le transfert de matière.
La tendance naturelle du transport est de suivre la ligne ayant la plus forte pente du champ potentiel. Cependant, les porteurs ne choisissent toujours pas le chemin le plus court entre les points extrêmes ; le long de la "route", il peut survenir bien d’accidents à cause des obstacles : chocs, déviations, retours, coalescence, entraînement.
L’influence du milieu sur le transport est déterminée par une caractéristique globale de comportement appelée conductivité.
La loi fondamentale du transport dans une direction x s’exprime par la relation :
∂E/∂t = – χ∂Π/∂x (4.1)
qui contient la plupart des éléments communs, spécifiques du transport.
Le signe négatif illustre le fait que le transfert s’effectue dans le sens des potentiels décroissants. Peut ainsi représenter une concentration de matière, une enthalpie volumique ou une quantité de mouvement rapportée
à l’unité de volume. Dans cette relation :
– ∂E – la quantité d’entité transférée ;
– ∂E/∂t – le flux d’entité transférée ;
– χ – la conductivité du milieu ;
– ∂Π – la chute de potentiel ;
– ∂x – segment d’itinéraire ;
– ∂Π/∂x – le gradient de la chute de potentiel.
Selon les différentes caractéristiques (entités) transportées, la loi fondamentale
(4.1) devient :
– la loi de Fick – exprime le débit de matière transférée par unité de volume :
dm/dt = kl.a.ΔC
– la loi de Fourier – donne la quantité de chaleur traversant la surface S :
dQ/dt = ks.SΔT
– la loi de Newton exprime la quantité de mouvement transférée à travers la surface S :
d(m.w)/dt = k.S.Δw
Les transferts de chaleur se rencontrent partout dans l’industrie, surtout là où la récupération thermique est considérée comme une économie d’exploitation. C’est encore plus vrai dans l’industrie chimique où les
réactions sont naturellement accompagnées de dégagement ou d’absorption de chaleur.
Les transferts de matière et de quantité de mouvement sont, eux, plus spécifiques de l’industrie chimique : c’est le cas de l’extraction par solvants ou de l’échange d’ions pour les premiers ; de la filtration, de la
décantation ou de la centrifugation pour les seconds.
Mais ces transferts sont souvent complexes et beaucoup d’opérations unitaires (la distillation par exemple ou le séchage), qui reposent sur des équilibres entre phases, sont caractérisées par un transfert simultané de
chaleur et de matière. Elles peuvent aussi être accompagnées de transferts de quantité de mouvement dus, entre autres, à l’agitation artificielle des fluides.
IIB.2 Types de transport
Les transports sont des phénomènes irréversibles qui se produisent dans des systèmes matériels hors d’équilibre. D’après la nature de porteurs et les conditions dans lesquelles s’effectue le transfert, on peut distinguer les types de transport.
Ø Transport radiant
Lorsque les porteurs de charge se déplacent sur une trajectoire droite entre les points extrêmes. Le transport par le rayonnement électromagnétique et le transfert à faible pression (sans chocs entre les molécules du gaz) illustrent ce type de transport.
Ø Transport par diffusion
Lorsque l’entité transférée est transportée par de porteurs de nature moléculaire selon un chemin désordonné (intervalles courts et inégaux) parmi les molécules du milieu, avec collisions et déviations fréquentes
et, implicitement, avec transfert de charge vers autres porteurs. L’orientation générale du transport reste cependant celle de la chute de potentiel.
Dans les conditions du transport par diffusion, la variation en temps du potentiel d’une entité s’exprime par l’équation :
où D est la diffusivité du milieu vers l’entité transférée.
En écrivant cette équation pour un transfert dans une direction x donnée, on obtient :
– pour le transfert thermique :
∂T/∂t = a.∂2T/∂x2 (4.3)
– pour le transfert de matière :
∂C/∂t = D.∂2C/∂x2 (4.4)
avec : a – la diffusivité thermique et D – constante de diffusion.
Ø Transport par convection
Pour le fluide en mouvement au transport par diffusion vient s’ajouter un transport par convection, les porteurs, de type par convection, étant entraînés dans le mouvement local et général – laminaire ou turbulent – du milieu.
le transport par convection, laminaire, dû aux porteurs de nature moléculaire, est décrit par l’équation (dans la direction x) :
∂Π/∂x = D ∂2Π/∂x2 – ∂(wxΠ)/∂x (4.5)
Avec wx – la vitesse du fluide dans la direction x. transport par convection, turbulent, dus aux agrégats moléculaires, les volumes macroscopiques de fluide, les tourbillons, locaux générés par les instabilités locales de l’écoulement avec forts gradients de vitesse.
La turbulence, provoquée par la variation de la vitesse en intensité et en direction, contribue à amplifier le flux transporté. L’équation du transport turbulent, semblable à (4.5), ajoute au coefficient de proportionnalité par diffusion moléculaire l’effet de la diffusion turbulente :
∂Π/∂x = (D + Dt)∂2Π/∂x2 – ∂(wxΠ)/∂x (4.6)
où Dt est le coefficient de diffusion par turbulence.
Dans le transport par convection on distingue également :
– la convection libre, dans laquelle la vitesse wx dépend du potentiel Π ; le mouvement spontané des agrégats de molécules est dû à des causes internes (modifications locales de masse volumique, température),
– convection forcée, dans laquelle la vitesse wx est indépendante de potentiel.
Ce type de convection s’explique par le mouvement d’ensemble d’agrégats de molécules, les causes sont extérieures (pompage, agitation).
À la différence des phénomènes de diffusion, la convection révèle des mouvements observables de la matière.
Ø Transport interphasique
Il se produit lorsque l’itinéraire parcouru traverse deux ou plusieurs phases, étant caractérisé par la modification de la nature des porteurs de charge dans chaque phase et par « cassures de pente » du gradient de potentiel, à chaque interface.
Il est admis que les obstacles devant le transport interphasique apparaissent dans les couches minces de deux côtés de l’interface et que dans ces couches limites existent des gradients de potentiel très importants. La
turbulence locale dans les couches voisines à l’interface diminue la résistance de l’obstacle.
L’équation générale du transport interphasique est :
dE/dt = ΔΠ/Σ(1/ kiS) (4.7)
dans laquelle :
– ki – coefficient de transfert pour l’obstacle (phase) i ;
– S – surface sur laquelle se fait le transport.
Le coefficient de transfert ki est défini par l’équation :
ki = (dE/dt)/S.ΔΠi (4.8)
avec ΔΠi – la chute de potentiel correspondant à la phase i.
IIB.3 Transfert thermique
IIB.3.1 Généralités
Les multiples procédés utilisés dans l’industrie sont très souvent le siège d’échange de chaleur, soit parce que c’est le but recherché (fours, coulée, échangeurs, thermoformage, induction, lits fluidisés, trempe, refroidissement), soit parce que ceux-ci interviennent d’une manière inévitable (chocs thermiques, pertes de chaleur, rayonnement). L’étude de phénomènes thermiques qui accompagnent la propagation de la chaleur et le calcul des valeurs du flux thermique représente l’objectif fondamental du transfert thermique (ou de la chaleur) ou thermocinétique. Cette partie importante de la physique traite aussi la description des mécanismes des modes de la propagation de la chaleur, conduisant à des relations établies soit théoriquement, soit sur la voie expérimentale entre le flux thermique transféré, les paramètres caractéristiques du système (propriétés physiques, géométrie) et les conditions thermiques de son milieu environnant.
Le transfert thermique est un processus complexe qui est réalisé par la superposition des trois modes fondamentaux : conduction, convection et rayonnement. Dans le cas où l’un de ces trois modes est déterminant, les effets des autres sont peu importants ; aussi ils peuvent être négligés, simplifiant considérablement l’analyse du cas concerné.
La conduction thermique est la transmission de la chaleur par vibration moléculaire, entre deux éléments dont les températures sont différentes au travers des éléments matériels qui les relient l’un à l’autre, sans qu’il y ait mouvement du milieu. Elle concerne spécialement les solides, mais aussi les liquides et les gaz pour lesquels elle est souvent négligeable par rapport à la convection ou au rayonnement. Les conditions générales définissant le déroulement du processus de conduction thermique se réfèrent à l’établissement des éléments suivants :
– le corps est homogène ou hétérogène ;
– le corps est isotrope ou anisotrope ;
– le corps contient ou pas de sources intérieures de chaleur ;
– le régime thermique est constant ou transitoire ;
– la propagation de la chaleur se fait de façon uni-, bi- ou tridirectionnelle.
C’est la loi de Fourier qui régit la conduction ; elle exprime la relation existant, en chaque point d’un corps, entre le flux thermique et le gradient de température ; le flux de chaleur transféré (relatif à la surface d’une
paroi plane, cylindrique ou sphérique) par conduction dans une direction donnée est proportionnel au gradient de température dans cette direction. Ainsi la composante sur l’axe Ox du flux est telle que :
Φx = – λ(dT/dx)S (4.9)
Dans cette expression, le coefficient de proportionnalité λ est une caractéristique physico-chimique du point matériel désignée sous le nom de conductivité ou conductibilité thermique.
Le signe (–) désigne que le flux de chaleur est positif quand le gradient thermique est négatif (il s’écoule du plus chaud vers le plus froid).
Le calcul intégral permet de généraliser la loi de Fourier à des corps de forme quelconque. Les valeurs de la conductivité thermique (propriété d’un matériau à conduire la chaleur) vont de quelques centaines de W/
m.K pour les métaux à 0,1-1 W/m.K pour les liquides et à 0,02 W/m.K pour les gaz. Les corps dont la conductivité est de l’ordre de 0,1 W/m.K (conductivité apparente) sont dits isolants.
La convection définit le transfert de chaleur dans un fluide (gaz ou liquide) dont les molécules sont en mouvement ; elle est donc étroitement liée à l’écoulement des fluides. Le transfert de chaleur par convection est caractérisé par quatre catégories de facteurs :
A. La nature du mouvement
Si les mouvements du fluide sont provoqués par les différences de densité qui existent entre deux éléments de volume contigus du fluide, ces différences étant provoquées par les différences de température, alors il y a interaction entre le processus d’écoulement et celui thermique, la réunion de ces deux phénomènes constituant ce qui s’appelle la convection naturelle ou libre. L’effet d’une action mécanique extérieure qui provoque l’écoulement du fluide (pompe, ventilateur) définit un mouvement forcé, tandis que
le transfert de chaleur entre paroi et fluide exprime la convection forcée.
B. Le régime d’écoulement
En fonction du critère de Reynolds, on observe les processus de transfert suivants :
– convection en régime laminaire, quand 0 < Re < 2 300 ;
– convection en régime transitoire, quand 2 300 < Re < 10 000 ;
– convection en régime turbulent, quand 10 000 < Re.
Pour le régime laminaire la convection se fait essentiellement par conduction thermique ; l’apport du mouvement de fluide est très réduit.
Dans le cas du régime turbulent la convection se produit par conduction thermique dans la couche limite et par transfert de masse et mélange dans la zone centrale de l’écoulement. Il est évident que la turbulence du
fluide qui génère un transfert de masse confère à la convection turbulente une intensité plus grande qu’à la convection laminaire.
C. Les propriétés physiques du fluide
Le transfert de chaleur par convection est affecté spécialement par la conductivité thermique, la chaleur spécifique, la diffusivité thermique, la densité et la viscosité dynamique, propriétés dépendant pour chaque
fluide de la température et dans une moindre mesure de la pression.
D. La forme et les dimensions de la surface d’échange thermique
La géométrie de la surface d’échange (plane, cylindrique, nervurée) et l’orientation de celle-ci par rapport à la direction d’écoulement influencent les caractéristiques de la couche limite et créent des conditions spécifiques d’écoulement et de transfert de chaleur.
Les facteurs cités permettent l’établissement de certains critères de classification
des processus de convection. On peut citer :
– pour le changement d’état :
• convection sans changement d’état du fluide (monophasique) ;
• convection avec changement d’état : condensation, ébullition.
– pour la nature du mouvement :
• convection libre (naturelle) ;
• convection forcée.
– pour le régime de l’écoulement :
• convection en régime laminaire ;
• convection en régime turbulente.
– pour la caractéristique géométrique de l’espace dans lequel se déroule
la convection :
• convection dans les espaces clos ;
• convention dans les espaces ouverts.
Le transfert de chaleur d’un fluide à un autre fluide à travers une paroi solide est le phénomène le plus fréquemment rencontré dans l’industrie chimique ; il peut se produire sans changement de phase, les deux
fluides restant dans le même état physique. Il peut également se produire avec un changement de phase, par exemple lors de la condensation d’une vapeur avec un liquide froid ou de l’évacuation d’un liquide à l’aide d’un gaz condensable ou non.
Le rayonnement thermique est l’émission par un corps d’ondes électromagnétiques qui sont les vecteurs de ce transfert de chaleur. Les ondes sont émises dans toutes les directions et appartiennent au domaine de l’infra- rouge et du visible. Aucun support matériel n’est nécessaire pour leur
propagation.
Dans de nombreux problèmes de transformation d’énergie thermique, les trois modes de transfert de chaleur coexisteront mais, généralement, au moins une des trois formes pourra être négligée, ce qui simplifiera le
traitement mathématique de l’appareil de transfert. Il faut savoir, qu’aux températures ordinaires, le transport par rayonnement est négligeable, mais il peut devenir notable et prépondérant lorsque le niveau de température augmente.
En outre, on doit signaler que certains transferts thermiques sont accompagnés d’un transfert de matière entre deux phases. Le flux de chaleur transféré en présence d’un changement de phase dépend de la nature et
des propriétés physico-chimiques des phases en présence. C’est le cas de l’ébullition, de la condensation, mais aussi des problèmes d’humidification, de séchage, de cristallisation, etc.
IIB.3.2 Échangeurs de chaleur
Le refroidissement et le chauffage nécessaire au bon fonctionnement de divers appareils et installations sont réalisés à l’aide d’échangeurs ou de systèmes de transfert thermique. On utilise aussi des échangeurs pour la
récupération de l’énergie calorifique en fin d’opération industrielle (chaleur sensible des fumés, des produits sortant des fours, des vapeurs ou gaz sortant des turbines). Au sens général, le terme d’échangeur de chaleur
s’applique à des appareils très divers. Beaucoup ont reçu des noms rappelant leur rôle dans une opération complexe : rôle fonctionnel (réchauffeur d’air, d’eau, vaporisateur, surchauffeur, resurchauffeur), rôle économique (économiseur, récupérateur).
Dans un échangeur de chaleur, la chaleur est transmise entre un fluide de service (eau, vapeur d’eau, fluide thermique) et un fluide procédé qui
constitue le produit intéressant de la fabrication. Le même fluide peut conserver son état physique (liquide ou gazeux) ou se présenter successivement sous les deux phases (cas des condenseurs et des vaporiseurs).
Dans tous les cas, un transfert de chaleur ne peut se produire qu’entre des corps portés à des températures différentes, et toujours du corps chaud vers le corps froid ; le phénomène cesse lorsqu’il y a équilibre des
températures. Dans tout appareil de ce type, on essaie de maximiser le transfert calorifique ; le principe d’un tel dispositif fait intervenir deux grandeurs qui conditionnent le résultat final : la différence de température
entre les fluides et la surface de contact. Il existe de nombreuses dispositions relatives aux fluides et aux surfaces d’échange ; la solution adoptée dépend essentiellement du problème à résoudre et des gaz ou
liquides mis en jeu, et se détermine par calcul. Dans la pratique deux cas
généraux se produisent :
· l’échangeur disponible étant connu (type, surface), on veut savoir s’il peut convenir pour fournir ou enlever un flux de chaleur déterminé à un fluide procédé dont on connaît le débit et les températures d’entrée et de sortie qui sont imposées. On calcule alors par un bilan thermique le débit de fluide de service qui permettra d’effectuer ce transfert à partir des températures d’entrée et de sortie de ce fluide (imposées dans la pratique si on utilise de l’eau de réseau). Il est alors possible de déterminer le coefficient de transfert thermique global K nécessaire. On vérifie ensuite que le coefficient K calculé à partir des relations de transferts thermiques (calculs entre autres des coefficients de convection) est bien supérieur à celui déterminé à partir des données générales sur les fluides et la surface totale de l’échangeur ;
· on souhaite calculer l’échangeur qui permettra de fournir ou enlever à un fluide procédé un certain flux de chaleur (débit, températures d’entrée et de sortie connus du fluide procédé). On raisonne comme plus haut concernant le fluide de service et il devient alors possible de déterminer la surface d’échange nécessaire en estimant a priori un coefficient de transfert thermique global K. On vérifie alors aussi par des calculs si la valeur de K supposée est correcte.
Dans ces deux cas, si les solutions ne conviennent pas il faut reprendre les calculs depuis le début en modifiant les hypothèses jusqu’à obtenir une solution satisfaisante. Cette procédure itérative est actuellement réalisée par des programmes informatiques.
Une classification des échangeurs peut considérer plusieurs points de vue : d’après leur principe de fonctionnement, leur forme de construc- tion, leur fonction, leurs applications, le mode d’écoulement des fluides, la nature des fluides qui les traversent, etc.
Le type le plus simple comprend un récipient (ou canalisation) dans lequel les deux fluides sont directement mélangés et atteignent la même température finale. Les réchauffeurs d’eau (injection de vapeur d’eau sous pression), les désurchauffeurs industriels et les condenseurs à injection sont des exemples de tels appareils appelés échangeurs à contact direct.
En principe, pour les échangeurs les plus répandus dans l’industrie, les échangeurs à surface (Figure IIB.1), les fluides s’écoulent simultanément dans des espaces séparés par une paroi, ou cloison, à faible inertie thermique.
Cette surface, métal ou un autre matériau, est traversée par le flux de chaleur qui est ainsi transmis d’un fluide à l’autre. L’expression échangeur de chaleur se rapporte le plus souvent à cette deuxième catégorie
d’appareils. La construction des échangeurs à surface introduit deux grandes catégories : échangeurs tubulaires à corps cylindrique et échangeurs compacts, dans lesquels coexistent les trois modes d’écoulement relatif des fluides.
Les échangeurs tubulaires comprennent un distributeur, un corps de calandre (tube cylindrique de gros diamètre dans laquelle est placé le faisceau tubulaire) et une boîte de retour ou fond de calandre. Les surfaces d’échange peuvent atteindre plusieurs milliers de mètres carrés, les faisceaux tubulaires prenant des formes très diverses : faisceaux en épingle à cheveux (Figure 4.1 a), faisceaux constitués de tubes enroulés,
etc. Il existe plusieurs solutions pour favoriser le transfert thermique :
– chicanage de la calandre : on place des cloisonnements sur le trajet du fluide pour éviter qu’il ne suive un chemin préférentiel. La turbulence créée améliore également le transfert ;
– cloisonnement pour la circulation dans les tubes ou dans la calandre : on obtient ainsi des échangeurs multipasses côté tubes ou côté calandre. On augmente ainsi les longueurs de circulation (donc la surface).
Ces échangeurs ne sont pas très intéressants pour les échanges thermiques entre deux liquides. Par contre ces échangeurs prennent tout leur intérêt pour des échanges vapeur-liquide. Les échangeurs tubulaires horizontaux sont utilisés comme condenseurs alors que les échangeurs tubulaires verticaux constituent des condenseurs-réfrigérants. Le choix du matériau dépend de l’utilisation :
– acier au carbone pour un usage courant ;
– laiton amirauté pour les appareils travaillant avec de l’eau de mer ;
– aciers alliés et graphite pour les produits corrosifs et les températures élevées ;
– aluminium et cuivre pour les très basses températures.
Figure IIB.1 – Échangeurs de chaleur à la surface.
Les échangeurs à plaques sont constitués d’un empilement de plaques rainurées entre lesquelles circulent alternativement l’un ou l’autre liquide. Ils présentent l’avantage d’offrir des coefficients de transfert globaux élevés même avec des vitesses de liquide faibles grâce à une forte turbulence.
Ils complètent donc bien les échangeurs tubulaires dans le cas d’échange liquide-liquide. Ils présentent de plus des surfaces d’échange élevées pour un encombrement minimal. Le démontage des plaques
pour le nettoyage est également aisé. Par contre ils sont la cause de pertes de charges importantes ce qui augmente leur coût de fonctionnement.
Ces échangeurs se présentent sous diverses formes :
– les échangeurs à plaques hélicoïdales ;
– les échangeurs à plaques planes (Figure 4.1 b) ;
– les échangeurs à plaques munies d’ailettes ;
– les échangeurs à tubes munis d’ailettes ;
Leur réalisation est beaucoup plus délicate et onéreuse que les échangeurs tubulaires, ainsi ils ne sont généralement utilisés que pour des échanges ne nécessitant pas en valeur absolue de très grandes surfaces
d’échange.
Autres types d’échangeurs :
échangeurs polyblocs en graphite : le graphite a une grande inertie chimique et une excellente conductivité thermique. Ces échangeurs sont utiles dans le cas des liquides corrosifs qui passent dans des canaux usinés dans un bloc de graphite. Des élargissements sur certainesparties des canaux permettent de créer une turbulence favorable à l’échange thermique ; épingle chauffante : on immerge un tube dans la masse à chauffer ou à refroidir. Le serpentin correspond à la même technique ; double enveloppe : le fluide caloporteur circule dans la double paroi d’un réacteur pour chauffer ou refroidir son contenu ; liebig : il correspond à une version simplifiée à un tube d’un échangeur tubulaire. Il est utilisé en position verticale et joue fréquemment le rôle de condenseur de sécurité au-dessus d’un réservoir contenant un liquide très volatil ou d’un condenseur total d’une colonne de rectification
IIB.3.3 Calorifugeage
Il intervient quand des produits doivent être maintenus à une température supérieure ou inférieure à la température ambiante. On peut calorifuger soit des canalisations soit des appareils (échangeurs, réservoirs,
colonne de rectification, fours…). Le calorifugeage des canalisations est notamment indispensable quand on véhicule de la vapeur d’eau, un liquide organique à température de fusion élevée ou une solution concentrée
qui ne doit pas cristalliser avant l’arrivée dans une cuve.
On revêt l’appareil ou la tuyauterie avec de très mauvais conducteurs thermiques. Les matériaux alvéolaires (ils contiennent des alvéoles emprisonnant de l’air) conviennent très bien car la conduction dans l’air est très mauvaise et il y a de très nombreuses alvéoles. De même la convection peut difficilement s’établir dans les volumes très petits des alvéoles. Parmi les matériaux alvéolaires utilisés on peut citer la laine de
verre, le polystyrène ou le polyuréthane expansé.
IIB.4 .Transfert de matière
IIB.4.1. Généralités
Si dans un système, formé par un ou plusieurs composantes, la concentration varie d’un point à l’autre, il existe une tendance naturelle d’évolution vers un état d’équilibre. Ce phénomène, qui peut se produire en phase liquide comme en phase gazeuse, définit le transfert de masse (matière).
Les deux points entre lesquels se produit le transfert peuvent être situés dans une même phase ou dans deux phases distinctes. Le phénomène se produit jusqu’à ce que les concentrations entre les deux points considérés aient atteint les valeurs d’équilibre. Le mécanisme du transfert de masse, analogue au transfert thermique, s’appuie sur une loi élémentaire de la cinétique moléculaire qui explicite que le flux d’une entité transférée dans une direction x donnée est le produit de la diffusivité par un gradient de potentiel (potentiel de charge) d’une propriété volumique ; le moteur, dans le transfert de matière, est la variation spatiale de la concentration.
Lorsqu’on s’intéresse au transfert de matière, on doit distinguer deux cas, selon que le transfert se fait au sein d’une phase ou entre deux phases partiellement ou totalement immiscibles. En outre, chacune des phases peut être mobile ou immobile.
Une phase immobile ne signifie pas qu’il n’y a pas de mouvement d’ensemble des molécules, mais au niveau de la phase, le transport se fait uniquement par diffusion moléculaire, et il n’existe pas dans la phase de tourbillons provoquant – avec une dégradation d’énergie mécanique et
de quantité de mouvement – le brassage d’agrégats de fluide ayant des compositions différentes. Par opposition, dans le cas d’une phase mobile, le transport par diffusion des constituants n’est pas dû uniquement à la diffusion moléculaire mais aussi à la diffusion turbulente.
La vitesse de transfert est donnée par la loi de Fick qui montre que le flux molaire de matière NA qui diffuse dans un système isotherme et isobare, en unité de temps par l’unité de surface est proportionnelle au gradient
de concentration. Pour la diffusion uni-diréctionnelle x, la loi de Fick
s’exprime :
NA = -DAB.(dCA/dx) (4.10)
avec CA, la concentration molaire.
Le facteur de proportionnalité DAB porte le nom de coefficient de diffusion (du corps A en B) et le signe – montre que la diffusion a lieu dans le sens où la concentration diminue. Lorsque le transfert de masse s’effectue avec turbulence, on admet qu’un coefficient de diffusion turbulente Dt s’ajoute au coefficient de difusibilité D, avec Dt > D. Par ailleurs, on a supposé que dans le système, la concentration de différents points soit indépendante du temps, c’est-à-dire que le transfert de masse se fait en régime stationnaire ou permanent.
L’échange de matière peut être réalisé :
– soit par le mélange « discontinu » des phases ;
– soit selon un mode semi-continu, une phase étant fixe et l’autre mobile ;
– soit, selon un mode continu, les phases circulant à contre-courant, co-courant ou à courants croisés.
Lorsque le transfert est réalisé en discontinu, on met en présence dans un appareil convenable une charge de la phase qui renferme le soluté et une charge de la phase où doit pénétrer le soluté (solvant) ; on mélange intimement les deux phases, puis on les sépare. Afin de réaliser un transfert de matière en continu, on fait circuler sans interruption dans un appareil convenable (contacteur de phases) un courant de chacune des deux phases. On peut distinguer deux catégories d’appareils :
– ceux où l’échange s’obtient en plusieurs stades successifs, chacun d’eux permettant de réaliser le mélange et la séparation des phases.
Dans l’une ou l’autre des deux phases, le titre en soluté ne se modifie qu’à chaque stade. Sa variation est donc graduelle. Chacun de ces stades constitue ce que l’on appelle un étage ou un plateau. À l’intérieur de
l’échangeur, les étages sont matérialisés soit par une série d’unités distinctes comportant chacune un mélangeur et un séparateur, soit par des plateaux horizontaux disposés à l’intérieur d’une tour verticale.
Lorsque les phases quittant un étage sont en équilibre de composition, l’étage est dit parfait ou idéal ;
– ceux où le transfert de matière s’effectue progressivement depuis l’entrée jusqu’à la sortie de l’appareil. Dans les deux phases, la variation du titre en soluté est continue. On dit que le transfert s’effectue par
contact différentiel.
Les exemples typiques de transfert de matière sont :
– transfert de masse d’un gaz vers un liquide dans les opérations d’absorption et humidification ;
– transfert de matière d’un liquide à un gaz dans les opérations d’humidification et distillation ;
– transfert de substance d’un liquide vers un autre liquide dans l’opération d’extraction ;
– transfert de masse d’un fluide à un solide dans l’opération d’adsorption.
Toutes ces opérations se déroulent, généralement, dans des colonnes (ou tours) réalisées de façon à assurer un contact intime entre les deux phases concernées, afin de permettre la diffusion des constituants. Le
débit de transfert de masse est directement dépendant de la surface interfaciale entre phases et de la nature et le degré de dispersion d’un fluide dans l’autre.
IIB.4.2 Colonnes (contacteurs)
Appareils utilisés dans l’industrie chimique afin de réaliser des opérations d’échange de matière entre les différentes parties homogènes (phases) d’un mélange hétérogène. Ils fonctionnent généralement avec
deux phases (liquide-liquide, liquide-gaz) qui se déplacent à contre-courant, c’est-à-dire l’une dans le sens inverse de l’autre. Les colonnes (ou tours) sont employées pour la réalisation de certaines opérations comme
la distillation, l’absorption, l’extraction par solvant, etc. c’est-à-dire dans toutes les opérations où il est nécessaire d’assurer un contact intime entre les deux phases concernées, afin de permettre la diffusion des
constituants. La disposition verticale des colonnes permet d’utiliser la force de gravitation pour réaliser le mouvement de la phase la plus dense du haut vers le bas ; la hauteur peut varier de quelques mètres (tours de
laboratoires et installations pilote) à plusieurs dizaines de mètres (raffinage du pétrole).
L’enveloppe constituant la colonne peut être une virole monobloc (une seule pièce, à partir généralement d’un diamètre de 1,5 m) ou formée par plusieurs tronçons assemblés par brides. Chaque colonne est munie
d’un ou plusieurs orifices de visite (trou d’homme), et de différentes tubulures telles que : alimentation en gaz, sortie du gaz sec, injection de la phase liquide, élimination du liquide chargé, les tubulures de contrôle
et régulation. Le débit de transfert de masse est directement dépendant de la surface interfaciale entre phases et de la nature et le degré de dispersion d’un fluide dans l’autre. Trois catégories de principes d’opération
sont à la base de la conception de l’équipement :
– le mode d’écoulement des fluides : contre-courant, co-courant et croisé ;
– le mécanisme de transfert : différentiel ou intégral ;
– la phase continue : gaz ou liquide.
Le fonctionnement se fait le plus souvent en continu et en régime stationnaire, c’est-à-dire que la colonne est alimentée par des phases liquide
et gazeuse dont les débits et compositions sont constants. Chaque type de contacteur possède ses avantages et ses inconvénients qui le destinent à une utilisation ciblée. Le classement des colonnes se fait selon quatre types principaux, lesquels peuvent, par la suite, se combiner dans une grande variété afin d’obtenir le résultat recherché (Figure IIB.2).
Figure IIB.2 – Différents types de colonne de séparation (contacteurs) :
a) plateaux à calottes ; b) plateaux perforés ; c) turbogrid ; d) à disques ;
e) à pulsation ; f) à garnissage régulier (ruissellement).
· Colonnes à pulvérisation
Cet appareil, le plus simple contacteur liquide – gaz, est une colonne dans lequel le liquide est injecté par un dispositif de pulvérisation (buses) au sommet et la phase gazeuse se déplace de bas en haut. La pulvérisation
du liquide permet une augmentation de la surface de contact entre les deux phases, alors que le temps de contact caractérise l’intensité du transfert de masse. La résistance opposée au processus de transfert est réduite par le mouvement de rotation des gouttes de liquide. Les avantages essentiels de ce type de tours sont la simplicité relative de construction et de très faibles pertes de charge, raison pour laquelle on l’utilise
dans les phénomènes contrôlés par la résistance au transfert en phase gazeuse. Toutefois, les phénomènes d’entraînement de la phase liquide peuvent être importants, ce qui provoque en général une perte de liquide,
et oblige à utiliser des appareils de récupération.
· Colonnes à barbotage
Cette colonne est remplie de liquide dans lequel est dispersée, sous forme de bulles fines, la phase gazeuse. Le transfert a lieu pendant le déplacement des bulles vers la surface du liquide. Elle est utilisée pour les processus contrôlés par la résistance en phase liquide.
· Colonnes à plateaux
Très répandues dans les applications industrielles, elles permettent la combinaison des mécanismes de transfert rencontrés dans les colonnes précédentes. Le liquide circule par gravité de haut en bas tandis que le
gaz est injecté à contre-courant. Le passage du gaz se fait de plateau en plateau par des orifices dont la taille et la forme peuvent être très variables. Le liquide descend de plateau en plateau par des déversoirs situés le long de la paroi de la colonne. Le transfert de masse entre phases a lieu au moment de la formation des bulles et durant leur ascension dans la couche de liquide. Très efficaces, étant donné la grande surface de contact interphasique rapportée à l’unité de volume de colonne.
· Colonnes à garnissage
En principe, il s’agit d’une colonne prévue d’un plateau support et remplie de garnissage de types très divers, en acier, en plastique ou en céramique, capables d’assurer un contact intime entre les deux phases. Le liquide est distribué en tête de colonne le plus uniformément possible.
Le gaz est introduit sous le support et circule à contre-courant. Ce type d’appareil peut être utilisé pour les systèmes gaz – liquide où chacune des résistances contrôle le processus de transfert ou les deux résistances
sont importantes.
Certaines colonnes reçoivent une dénomination particulière en fonction du type d’opération qui y est réalisé : colonne de fractionnement, colonne de rectification, colonne de concentration.
IIB.5. Transport et manipulation des fluides
IIB.5.1 Notions de mécanique des fluides
1. Définitions
En mécanique, on appelle fluide un milieu considéré comme continu – à l’échelle macroscopique -, sans rigidité, pouvant subir de grandes déformations non élastiques sous l’action de forces qui peuvent être très
faibles. Il n’a pas de forme propre – il prend la forme du récipient qui le contient – et il présente la propriété caractéristique de pouvoir s’écouler.
Parmi les substances qui répondent à cette définition on trouve deux
types de fluides :
– les liquides, très peu compressibles, assez denses, qui occupent le fond des récipients où ils sont placés et présentent une surface supérieure généralement plane quand elle est libre. Exemples types, à 20 °C : l’eau,
l’alcool, l’huile, le vin, le sang, l’essence, etc. ;
– les gaz et les vapeurs, très compressibles et indéfiniment expansibles, qui occupent tout le volume qui leur est offert. Citons comme exemple : l’air, la vapeur d’eau, le dioxyde de carbone, etc.
Le fluide idéal (appelé encore fluide parfait ou fluide d’Euler) est un fluide considéré comme homogène, continu, déformable sans résistance (viscosité nulle) lorsque la déformation a lieu à vitesse finie, et incompressible ; le fluide réel est défini comme un milieu homogène, continu, qui oppose une résistance à la déformation. Tous les fluides réels ont une viscosité finie, mise en évidence par les phénomènes de
frottement.
Il existe différents types de fluides et de comportements différents de l’écoulement de ceux-ci. L’écoulement se produit lorsqu’une force externe, ou une tension, agit sur le fluide. Si l’écoulement commence dès
l’application de la force extérieure, comme c’est le cas pour les fluides les plus courants (eau, alcool, etc.) on dit que le fluide est newtonien du nom de Newton qui, le premier, formula une théorie quantitative de la viscosité.
D’autres types de fluides nécessitent l’application d’une intensité minimale de force avant que leur écoulement commence. De tels fluides sont dits non newtonien et leur type d’écoulement est appelé écoulement plastique. Il s’agit de faire circuler les fluides dans des conduites et dans les appareils,
de prévoir les pertes de charge correspondantes et de choisir le type de pompe le mieux adapté. Les fluides rencontrés dans les opérations chimiques sont très divers : fluides normaux ou au contraire non newtoniens
comme par exemple les polymères fondus ; milieux diphysiques constitués de fluides non miscibles où de dispersions de bulles, de gouttes ou de grain ; gaz qu’il faut comprimer et détendre, ou faire circuler sous
très basse pression (séparation des isotopes par diffusion gazeuse). De plus, ces fluides présentent souvent une agressivité chimique qui nécessite l’usage de matériaux de construction résistant à la corrosion.
2. Écoulement des fluides
L’écoulement d’un fluide est le mouvement du fluide comme continuum. Un fluide s’écoule, tandis qu’un solide se déplace en bloc.
L’écoulement est caractérisé par un champ de vitesse, par la pression et par
certaines propriétés de ce fluide telles que la densité et la viscosité ; cette dernière est d’une importance particulière dans l’étude des écoulements.
L’écoulement d’un fluide réel est dit laminaire s’il se déplace en formant des lames ou couches entre lesquelles il n’y a pas de mélange. L’écoulement désordonné d’un fluide réel est dit turbulent s’il se déplace en formant des bouffées ou tourbillons de tailles différentes accompagnés d’un mélange ou brassage intensif des particules fluides. La vitesse et la pression en un point fixe présentent des fluctuations aléatoires autour d’une valeur moyenne. Un écoulement est dit permanent ou stationnaire lorsque les grandeurs caractéristiques du fluide (densité) et de l’écoulement (pression, vitesse), sont constantes dans le temps. Ainsi, la vitesse est indépendante par rapport au temps, mais elle peut varier d’un point à l’autre dans l’espace. En un point fixe, il n’y a pas de changement de vitesse dans le temps. L’écoulement turbulent, lui-même non permanent, peut être permanent en moyenne. La plupart des problèmes d’écoulement des fluides dans l’industrie concernent l’écoulement permanent.
Un écoulement est dit uniforme si l’accélération convective est nulle ; la vitesse ne dépend donc pas de la position dans l’espace. Par conséquent, dans un écoulement uniforme, les vecteurs vitesse sont parallèles en tout point. L’écoulement de liquides sous pression le long des conduites de diamètre constant est uniforme qu’il soit permanent ou non. Un écoulement qui se produit dans une conduite dont la section varie lentement peut être étudié approximativement en supposant que la vitesse est perpendiculaire à la section droite et uniforme dans cette section.
La vitesse ne dépend donc que d’une seule dimension, l’abscisse
curviligne de l’axe de la conduite, d’où le nom d’écoulement unidimensionnel.
L’écoulement le plus général dépend des trois variables spatiales,
x, y, z ; on l’appelle alors écoulement tridimensionnel. Il existe des cas particuliers
où les variables sont ramenées à deux ; on l’appelle alors écoulement bidimensionnel ou plan.
3. Viscosité
Lorsque des fluides sont mis en mouvement, des forces de frottement internes s’opposent à leur mouvement. Cette résistance interne à l’écoulement est appelée la viscosité du fluide. Dans les liquides, elle résulte de
forces de cohésion intermoléculaires qui s’apposent à toute force appliquée de l’extérieur, alors que dans les gaz c’est le mouvement des molécules entre des portions du gaz se déplaçant à des vitesses différentes qui
est responsable de la résistance à l’écoulement. Les théories sur lesquelles on a basé la mesure quantitative de la viscosité correspondent à un fluide s’écoulant de façon laminaire. Newton donna la formule permettant
de calculer l’amplitude de la force de frottement interne dans un liquide en mouvement. Cette force est le produit de la surface du liquide, du gradient de vitesse et d’une constante caractéristique de chaque liquide appelée coefficient de viscosité dynamique, ce qui s’écrit :
Ff = - γS(dw/dx) (4.11)
Pour s’affranchir de l’aire du plan considéré et ramener ainsi les forces à l’unité de surface, on définit la contrainte tangentielle de cisaillement par le rapport :
τ= Ff /S = - μ (dw/dx) (4.12)
où la direction Ox est perpendiculaire à la vitesse. Le signe – traduit la diminution de la vitesse quand on s’éloigne de l’élément de surface considéré. Cette relation est connue sous le nom de loi de Newton. Un
fluide est visqueux si l’effort qui le déforme dépend de la vitesse de déformation et croit avec elle. Cette propriété se superpose à l’élasticité.
Dans de nombreux problèmes, la viscosité dynamique est associée à la masse volumique sous la forme ѵ= μ/ρ; ce quotient le nom de viscosité cinématique. L’inverse de la viscosité dynamique désigne la fluidité. La viscosité conduit à distinguer deux catégories de fluides :
– les fluides newtoniens qui satisfont la loi de Newton. La viscosité d’un tel fluide ne dépend que de sa nature et de sa température ;
– les fluides non newtoniens pour lesquels la viscosité dépend du gradient de vitesse. L’étude de ces fluides fait l’objet de la rhéologie. Dans la plupart des cas, il suffit de comparer la viscosité des fluides plutôt que de mesurer réellement un coefficient de viscosité. On utilise pour cela des viscosimètres. Ils sont basés sur la vitesse d’écoulement dans un tube étroit ou au travers d’un orifice, ou bien sur la vitesse de chute d’un objet dans un liquide, ou encore sur la résistance d’un liquide à un objet mis en rotation dans un liquide. D’une façon générale la viscosité est très sensible avec la température ; ainsi la viscosité d’un liquide diminue lorsqu’il y a élévation de température (frottements plus faibles suite à une augmentation des distances intermoléculaires) et il est important de connaître la viscosité et sa variation avec la température afin de
déterminer, par exemple pour une huile, son aptitude à répondre aux exigences de la lubrification ; dans les huiles lubrifiantes pour l’automobile on recherche des formulations dans lesquelles la viscosité varie peu
avec la température (huiles multigrades). Pour les gaz, la viscosité croit avec la température, car l’augmentation de température entraîne également une augmentation de la vitesse des molécules et par conséquent le taux de collision.
4. Perte de charge
L’écoulement des fluides réels s’accompagne toujours de pertes d’énergie (∆pf) le terme « perte de charge » étant ainsi introduit afin d’exprimer de façon globale la chute de pression entre l’entrée et la sortie d’une même conduite. On considère deux types de perte de charge correspondant tous deux à une dissipation irréversible d’énergie, transformée en chaleur.
La chute de pression attribuée aux seuls frottements visqueux au sein du fluide et contre la paroi solide définit une perte de charge linéaire ou régulière ; elle est fonction de la longueur de la conduite. Pour un écoulement avec variation brusque de vitesse due à une variation locale de géométrie dans la conduite (vannes, coudes, tés, appareils de mesure, etc.) on détermine la perte de charge singulière à partir de la variation de la quantité de mouvement.
Une bonne connaissance des pertes de charge est l’une des conditions fréquemment nécessaires au dimensionnement correct d’une installation hydraulique, de manière à assurer son bon fonctionnement. Pour
un écoulement complètement développé, des travaux expérimentaux ont montré que la perte de charge, dans une conduite de longueur L et diamètre d, peut s’exprimer sous la forme :
∆pf = λ(L/d)(w2/2) ρ (4.13)
avec λ coefficient de frottement de Darcy. Cette relation où w est la vitesse du fluide et ρ sa masse volumique, dite équation de Fanning-Darcy, s’emploie
pour le calcul de ∆pf par frottement, en régime laminaire et turbulent, dans les conduites.
En écoulement laminaire λ = 64/Re (Re – nombre de Reynolds) ne dépend pas de la rugosité, ce résultat, vérifié par des données expérimentales, s’explique par le fait que la viscosité du fluide annule l’effet des rugosités de la paroi. En écoulement turbulent, plusieurs formules empiriques existent, mais afin d’éviter des calculs très complexes, on utilise un diagramme logarithmique établi pour des canalisations industrielles dont le plus connu est celui de Moody.
4. Dispositifs de transport des fluides
■ Compresseurs
On désigne par compresseur les machines qui comprime un fluide dont la pression de sortie – pression aval – est supérieure à la pression atmosphérique, et par pompes à vide les machines dont la pression de sortie est
égale à la pression atmosphérique. La distinction ne porte en fait que sur la pression qui intéresse l’utilisation car dans tous les cas, la pression aval est supérieure à la pression amont. Selon qu’ils emploient toujours le même fluide, en le soumettant à des compressions et des décompressions successives (surtout dans les installations frigorifiques), ou qu’ils doivent fournir un jet continu de fluide à une pression donnée (par exemple air comprimé), on peut avoir des compresseurs à cycle fermé et des compresseurs à cycle ouvert. D’après leur fonction mécanique, on peut distinguer des compresseurs alternatifs et des compresseurs rotatifs.
Dans les compresseurs alternatifs, le fluide est aspiré dans un cylindre dans lequel il est comprimé par un piston qui est déplacé par un système bielle-manivelle transformant le mouvement de rotation de l’arbre moteur en un mouvement de translation alterné. Les compresseurs rotatifs peuvent créer des chambres à volume variable en utilisant les capsulismes, ou bien ils peuvent être du type centrifuge ou du type axial. Dans les compresseurs centrifuges, l’organe tournant est un disque pourvu des palettes fixes, droites ou courbes, qui impriment au fluide (qui pénètre au centre), un mouvement radial vers l’extérieur ; l’énergie cinétique correspondante est transformée en énergie de pression en faisant parcourir au fluide des conduits ayant une section croissante. Dans les compresseurs axiaux, le courant du fluide se déplace dans la direction axiale en raison de l’action des palettes ayant un profil aérodynamique, portées par un tambour tournant ou fixées à la caisse. L’ensemble d’un compresseur et de son moteur d’entraînement (électrique, diesel ou à explosion) est un motocompresseur.
Si le compresseur est monté sur le même arbre qu’une turbine, il devient alors un turbocompresseur. En première approximation, un compresseur à piston couvre le domaine des faibles débits refoulés à des pressions élevées, le compresseur rotatif refoule des débits un peu plus élevés mais sous des pressions modérées, alors que le turbocompresseur est à même de refouler des débits moyens ou très élevés avec des rapports de compression allant des plus faibles aux plus élevés. La frontière entre les compresseurs à piston et les turbocompresseurs se situe approximativement vers des débits de 104 m3/h (puissance d’entraînement
supérieure à 1-5 MW) (Figure 4.3) Puisqu’on peut utiliser l’augmentation de la pression comme source d’énergie cinétique, indépendamment de l’augmentation de la température, l’emploi des compresseurs peut être étendu à de nombreux secteurs de la technique ; dans l’industrie chimique, les applications possibles et les différents fluides employés sont répertoriés : air, azote, méthane, chlore, éthylène, vapeur d’eau, fluides frigorifiques.
Figure 4.3 – Domaines d’applications de différents types de compresseurs – D :
compresseur à membrane ; P1 : compresseurs à piston exempts d’huile ;
P2 : compresseur à piston à cylindres lubrifiés ; P3 : compresseurs à piston
à très haute pression ; S : compresseurs à vis ; TA : turbocompresseurs axiaux ;
TR : turbocompresseurs radiaux.
■ Pompes
On appelle pompes les machines qui réalisent l’écoulement d’un liquide en utilisant une certaine quantité d’énergie mécanique fournie par un moteur. Cette dépense d’énergie est nécessaire parce que l’écoulement a
lieu dans le sens des pressions croissantes ; la pompe doit, par conséquent, vaincre une certaine résistance dont la nature varie suivant l’utilisation de l’appareil. Dans tous les cas, la résistance à l’écoulement se trouve accrue par suite des pertes de charge subies par le liquide dans les conduites, particulièrement lorsque celles-ci comportent des changements de direction ou de section. En exceptant les pompes manuelles, destinées à fonctionner pendant de courtes périodes, une pompe est entraînée par une source de puissance. On rencontre la motopompe, la turbopompe ou l’électropompe, suivant que l’entraînement a lieu à partir d’un moteur à pistons, d’une roue de turbine ou d’un moteur électrique. On doit préciser chaque fois la notion de roue de turbine, car dans le langage courant, le terme turbine désigne la plupart du temps une installation complète. La fonction essentielle de ces appareils n’est pas tant de mettre les fluides en mouvement que de leur fournir de l’énergie, laquelle est ensuite utilisée pour augmenter la pression ou la vitesse ou encore accroître l’énergie de situation (en élevant le fluide).
Les pompes communiquent au fluide soit principalement de l’énergie potentielle par l’accroissement de la pression en aval, soit principalement de l’énergie cinétique par la mise en mouvement du fluide avec apparition d’un débit d’écoulement analogue au courant électrique.
Pour un trajet déterminé, l’énergie spécifique de pompage, W peut se déterminer à l’aide de l’équation de Bernoulli ; elle a pour effet :
– l’élévation du fluide de la hauteur Z1 à la hauteur Z2, donc une augmentation de l’énergie potentielle ;
– l’accroissement de l’énergie cinétique, en imprimant au fluide une
vitesse w2 > w1 ;
– la réalisation d’une pression p2 > p1 ;
– l’accroissement de l’enthalpie du fluide h2 > h1 ;
– la compensation des forces de frottement le long de la canalisation.
Ces effets apparaissent, dans la plupart des cas, simultanément. La détermination des dimensions d’une pompe et de la puissance qu’elle absorbe exige la connaissance de toutes les grandeurs qui interviennent dans la définition des conditions de fonctionnement. Parmi ces données figurent, en premier lieu, le débit de liquide G (qu’on peut désigner aussi par Gm, ou par Gv, si l’on veut préciser qu’il s’agit d’un débit-masse ou d’un débit-volume) et la hauteur d’élévation totale Zt. Cette dernière grandeur est la somme de deux termes correspondant l’un à l’aspiration, l’autre au refoulement.
L’énergie requise pour faire fonctionner ces machines dépend donc des nombreux facteurs rencontrés dans l’étude des écoulements ; ce sont, rappelons-le :
– les propriétés du fluide : masse volumique, viscosité, compressibilité, etc. ;
– les caractéristiques de l’installation : longueur, diamètre, rugosité, singularités, étanchéité, etc. ;
– les caractéristiques de l’écoulement : vitesse, débit, hauteur d’élévation, pression, etc.
La conception et la réalisation des pompes industrielles présentent une grande diversité car, pratiquement, on peut pomper des fluides dans une gamme complète de températures entre – 250 °C et + 1 000 °C. D’une
manière générale, les différents types de pompes peuvent être divisés en deux classes : les pompes volumétriques et les pompes centrifuges.
Ces dernières appelées aussi turbopompes ou pompes hydrodynamiques constituent, et de loin, la catégorie de pompes la plus largement employée dans l’industrie. Les pompes centrifuges sont de construction très simple : en version de base, elles sont essentiellement constituées d’une
pièce en rotation – le rotor appelé aussi roue ou hélice suivant le cas – qui tourne dans un carter appelé corps de pompe (Figure 4.4). Une certaine vitesse est ainsi communiquée au fluide. Lorsque l’augmentation de la
pression motrice est recherchée, un divergent en forme de spirale récupère le fluide et convertit une grande partie de la vitesse en pression.
On différencie les pompes hydrodynamiques entre les pompes centrifuges (radiales), hélico-centrifuges et à hélice (ou axiales). La différence porte essentiellement sur la direction de la vitesse communiquée au fluide, et par conséquent sur la forme du rotor.
Figure 4.4 – Coupe d’une pompe centrifuge monocellulaire.
4.6 Nombres caractéristiques (NC)
Les nombres caractéristiques, encore appelés grandeurs ou produits sans dimension,
sont des rapports adimensionnels de groupements de grandeurs physiques (forces, vitesses, énergies, temps, etc.). L’utilisation des NC permet une simplification de l’écriture de la loi du phénomène étudié et,
dans certains cas, cette simplification donne des indications suffisantes pour prévoir la loi du phénomène. Cependant, quand la forme de la loi est trouvée, rien ne prouve l’existence de la loi physique correspondante.
Seule l’expérience peut en donner la preuve mais, si la loi existe, elle ne peut avoir que cette forme. L’étude expérimentale d’un phénomène est également facilitée par l’utilisation systématique des nombres caractéristiques à la représentation des résultats. Des expériences réalisées dans des conditions très différentes pourront se comparer plus facilement et, pour diminuer le prix de revient, les lois expérimentales pourront s’étudier sur des maquettes à l’échelle réduite. Les champs d’application les plus importants des nombres caractéristiques sont la dynamique des fluides, la théorie des turbomachines, la transmission de la chaleur et la magnétohydrodynamique.
On peut diviser les nombres caractéristiques en deux classes. La première classe comprend tous les nombres qui résultent de la combinaison de grandeurs indiquant les propriétés du milieu, par exemple des coefficients de viscosité, de conduction, de diffusion, des chaleurs massiques, etc. Les nombres de cette classe sont donc des propriétés d’état dont les valeurs numériques peuvent être déterminées pour chaque milieu fluide en fonction des paramètres d’état (par exemple la température et la pression si le milieu et homogène isotrope et de variance 2). La seconde classe comprend tous les autres nombres caractéristiques dont la valeur dépend, pour un milieu donné, non seulement de l’état thermodynamique, mais aussi des conditions de similitude géométrique, cinématiques et dynamiques.
On peut aussi y introduire une distinction entre les nombres caractéristiques qui expriment l’importance relative d’une grandeur par rapport à une autre de même dimension et ceux qui résultent de la présentation
adimensionnelle des grandeurs physiques (par exemple le coefficient de perte de charge linéaire , qui est une expression adimensionnelle de la perte de pression motrice par unité de longueur de la conduite).
Portant souvent le nom du chercheur qui les a introduits, les nombres caractéristiques les plus utilisés en génie chimique sont :
en transfert thermique : nombre de Nusselt, Nu ; nombre de Péclet (thermique), Peth ; nombre de Stanton, Stm ; nombre de Grashof, Gr ; en transfert de masse : Nombre de Sherwood, Sh ; nombre de Péclet (massique), Pem ; nombre de Stanton (massique), Stm ; en mécanique des fluides : nombre de Reynolds, Re ; nombre d’Archimède, Ar ; nombre de Froude, Fr ; en transfert simultané : Nombre de Prandtl, Pr ; nombre de Schmidt, Sc ; Nombre de Lewis, Le.



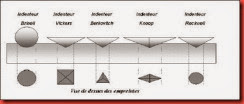
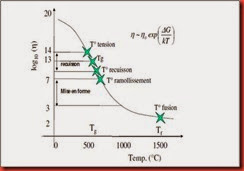
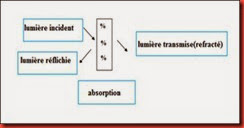

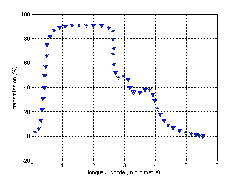


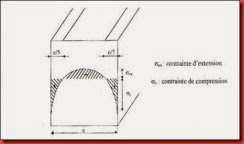
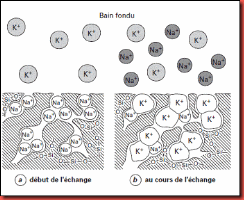
![clip_image002[9] clip_image002[9]](http://lh6.ggpht.com/-PPB8WvI-COw/U909bCFkvWI/AAAAAAAAAFc/ejCr4FEeYVk/clip_image002%25255B9%25255D_thumb.gif?imgmax=800)
![clip_image011[9] clip_image011[9]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgWAgT46jKs9VF_PSUbR-a0XGQDANxnaS5LuyZM0Z0f4uGqvGyiKBrECuVd1dUQFVIqMuQjby5sgTat25OUUgq8gGKv8zesz_WttShIEJTcwS3DOmVbnLYE2kfNd6ZCCN6m8METoU1LLq5l/?imgmax=800)
![clip_image013[9] clip_image013[9]](http://lh5.ggpht.com/-7hBr_yXLvP4/U909frhF1lI/AAAAAAAAAGM/zxlbJsdURj4/clip_image013%25255B9%25255D_thumb%25255B2%25255D.jpg?imgmax=800)
![clip_image038[9] clip_image038[9]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjdeKsk5VEmF_T6MxiIVdulWDXcf_VoEj6SyMh564GeNfQ9b3YiOvaMrtChZFLHb6UrID0ooXovX8dGMQryau4bG2pjfSQdtFuzc0Bef7ktLSDMiAzxpWdY83jfPjkBy3E7tnV-h3NgSAGe/?imgmax=800)
![clip_image040[9] clip_image040[9]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgZwPcWHutWsyZ2T1kbrIOkfLW8sOPYMOXE7n6Y22Kfr0-jsZ4BfcNUclLWhMgYQJLInZSKE9INRAMcTD0eHnowh7UegAdUlxdQ1IG5OV9525w-oRPv3j8pywqoPUsrHp9e1N52_PGb41YZ/?imgmax=800)
![clip_image042[9] clip_image042[9]](http://lh6.ggpht.com/-bnbCXQ8xmv0/U90-CGCMpBI/AAAAAAAAAMc/lGOHkNGjBak/clip_image042%25255B9%25255D_thumb%25255B2%25255D.jpg?imgmax=800)
![clip_image044[9] clip_image044[9]](http://lh6.ggpht.com/-M6s-NAMyCyQ/U90-Dko6viI/AAAAAAAAAMs/udo07AhdT9A/clip_image044%25255B9%25255D_thumb%25255B2%25255D.jpg?imgmax=800)