Définition des verres et leurs propriétés
Structure du verre
Classification des verres
Historique
Le verre est un des plus anciens matériaux de l’humanité, on peut le trouver à l’état naturel dans certaines roches d’origine volcanique ou météorique. Sa fabrication par l’homme remonte à la plus haute antiquité, la date de naissance du verre n’est pas facile à fixer avec précision, car elle varie avec le degré de sévérité adopté pour définir le verre, d’après MOREY .Les plus anciennes pates vitreuses étaient connues depuis environ 1200 ans avant Jésus-Christ, le verre pur date de 7000 ans avant Jésus-Christ. Les verres ont été trouvés en Egypte et ils ont été probablement ramenés d’Asie.
A l’occident, la fabrication du verre était dispersée sur des sites isolés après la chute de l’empire romain, mais elle était connue à Byzance et plus tard au moyen orient par les arabes. En l’année1300, Venise devenait le lieu de la naissance de l’industrie du verre en Europe, le progrès dans les techniques du verre et ses applications par la suite était rapide.
Le début de l’industrie artisanale du verre qui correspondant à l’utilisation de soufflage se situe au début de notre 15éme siècle. Au 17éme siècle avec le développement des connaissances dans le domaine de l’optique, sont apparus les premières instruments d’observations utilisant le verre (lunette télescope …) .L’industrie verrière pour la fabrication de bouteilles et de verres à vitres a commencée aux Etats Unis au début du 18éme siècle. En 1879, Monsieur Thomas Edison a inventé l’ampoule incandescente qui a changée les vies des millions de personnes tout autour du monde. C’est une application typique qui n’est possible sans l’utilisation de verre qui lui seul satisfait les propriétés nécessaires pour le fonctionnement : dureté, transparence, tenir le vide et résister aux températures élevées en même temps. Avec le progrès technologique, le champ d’application du verre n’a cessé de s’étendre surtout dans l’optique pour la fabrication des composants optiques tels que : les lentilles, les prismes, miroirs….etc. Son large spectre d’utilisation, la rendue indispensable dans des application fines de haute précision . Pour cette raison il a été classé comme «matériau noble» par la communication scientifique.
I.1. Définition du verre
Le verre est définit comme étant une substance dure homogène, généralement transparente, amorphe,isotrope, provenant du refroidissement progressif de certaines substances après fusion. Il est facile à modeler, peut prendre de nombreuses formes.
· Dans le langage scientifique, on désigne par le terme verre, un solide non cristallin obtenu par figeage d’un liquide surfondu.
· Dans le langage courant le terme verre sert à désigner un matériau fragile et transparent au rayonnement visible .
On trouve également d’autres définitions telles que « le verre est un solide amorphe de substance inorganique formé par solidification sans cristallisation ».
L’ASTM «Américain Society for Testing Matériels » définit le verre comme un produit minéral obtenu par fusion et qui se solidifie sans se cristalliser prend un état figé .
I.2. Structure du verre
Dans tout solide, il existe entre les éléments constituants un certain arrangement qui détermine sa structure. Il en est ainsi pour le verre, les éléments constitutifs du verre de silice sont les tétraèdres SiO4 qui sont assemblés par les sommets par des ions O-2 figure (I.1). Dans le cas de la structure cristalline (quartz) l’angle Si-O-Si est constant et égale à 140º, alors qu’il peut varier dans le cas de silice vitreuse autour d’une valeur moyenne de 145º. Cela suffit pour que le réseau de silice vitreuse soit désordonné.
 |
Figure. I.1 : Représentation schématique de la structure du verre de silice .
Le verre est un état instable de la matière, sa structure comporte un ordre à courte distance et un certain désordre si l’on considère un volume suffisamment grand .De ce fait, le terme solide non cristallin, solide amorphe et verre sont synonymes et présentent le phénomène de la transition vitreuse.
On peut obtenir des renseignements plus précis sur la structure du verre, en étudiant celle du liquide à partir du quel et en dépendance des conditions de refroidissement et de composition, le verre prend deux formes de structure figure (I.2).
· Refroidissement lent et composition quelconque : formation d’un réseau ordonné cristallisé (quartz, cristobalite) figure (I.3 a).
· Refroidissement rapide: on à la formation d’un réseau désordonné, arrangement irrégulier c’est une structure vitreuse « verre de silice » figure (I.3 b) .
| |
Figure.I.2 : Shéma montrant la variation du volume en fonction de la température .
Le verre est privé de l’arrangement parfait de l’état cristallin. Sa structure est aléatoire. Elle ne présente pas d’ordre à longue distance comme pour les solides cristallins, tandis que les cristaux ont des liaisons régulières et identiques entre tous les atomes. Les liaisons dans le verre sont souvent perturbées, déformées et cassées.
L’introduction de l’oxyde alcalin, comme l’oxyde de sodium Na2O, pour le verre sodocalcique, coupe les liaisons Si-O. Le réseau se trouve rompu et il y existe des discontinuités. Figure (I.3c)
| |
Figure.I.3 : Représentation schématique d’un réseau plan de silicate .
a-Silice cristalline (Cristobalite), b-Verre de silice, c-Verre sodocalcique.
I.3. Composition chimique des verres
Les verres sont pour la plupart des verres, des oxydes, pour fabriquer le verre, un ensemble de matières premières est utilisé constitué en majeur partie des rôches naturelles (sable calcaire) et des produits chimique, tels que le carbonate de sodium, le mélange hétérogène s’appelle mélange vitrifiable.
Il existe un nombre important de types de verre qui diffèrent suivant leurs compositions, leurs propriétés et leurs applications, les différentes composition du verre se compte aujourd’hui par milliers, suivant les caractéristiques chimiques de leurs composants principaux, on peut les classer en cinq catégories, verres d’oxydes, les verres d’halogénures, les verres métalliques et les verres obtenus à partir de sels ioniques et solution aqueuses.
Certains éléments comme le silicium et le bore peuvent former un verre par leur seul combinaison avec de l’oxygène par élévation à une très haute température. Ces oxydes sont appelés oxydes formateurs car ils forment le squelette du verre. On les combine avec d’autre élément dits « modificateurs » qui sont :
Ø Les fondants qui abaissent la température de fusion des oxydes formateurs (température de la silice est 1730°C).
Ø Les stabilisants qui modifient les propriétés physiques du verre atténuées par l’adjonction du fondant .
I.3.1. Oxydes formateurs
Ce sont des oxydes principaux, utilisé en grandes proportion pour former le réseau vitreux dont les plus importants sont : SiO2 verres à base silicates, B2O8 verres à base de borate, P2O8 verres à base de phosphate, et que pour chacun de ces formateurs, on peut introduire ensemble ou séparément des modificateurs très nombreux dont certains peuvent être partiellement formateurs, on peut voir l’étendue assez importantes de composition des verres possibles .
I.3.2. Oxydes modificateurs
Les oxydes modificateurs sont essentiellement, les oxydes alcalins par exemples Na2O, K2O ou bien des oxydes alcalino-terreux par exemples CaO. Ce sont essentiellement des composés ioniques. Les oxydes modificateurs dépolymérisent les réseaux des oxydes formateurs en détruisant ou bien alternant la structure de base, ce qui explique le rôle des modificateurs dans l’abaissement de la température de fusion des verres.Ils sont ajoutés pour faciliter la fusion des vitrifiant en s’insérant dans le réseau vitreux (rupture des ponts d’oxygènes ou oxygènes non pontant) et pour modifier les propriétés du verre formé par l’oxyde formateur, ces oxydes sont des composés ajoutés à la composition du verre, en quantités maîtrisées dont on peut citer :
· Na2O (oxyde de sodium) : obtenue à partir de carbonate de sodium Na2CO3, il abaisse la viscosité et la résistance chimique, augmente le cofficient de dilatation thermique, et la conductivité électrique.
· Li2O (oxyde de lithium) : qui augmente l’amplitude à la diffraction en diminuant la viscosité .
· CaO (oxyde de calcium) : obtenue à partir du calcaire CaCO3, il améliore la résistance chimique des verres en diminuant leur solubilité .
· K2O (oxyde de potassium) : obtenue à partir du carbonate de potassium K2CO3, agit sur la viscosité en augmentant ainsi l’intervalle de travail des verres .
· MgO (oxyde de magnésium) : améliore les caractéristiques de résistance des verres.
· BaO ( oxyde de baryum) : augmente l’indice de réfraction, d’où son application dans les verres optiques.
I.3.3. Oxydes intermédiaires
Ce sont généralement des oxydes qui ne sont pas capables de former un verre. Ils peuvent prendre une place dans la chaîne du verre. L’oxyde d’aluminium est un exemple d’un tel oxyde intermédiaire. Il joue le rôle de colorants ou d’affinant dans la composition chimique du verre. Les oxydes intermédiaires sont ajoutés en petites quantités dans le mélange vitrifiant. On peut citer AS2O3, AL2O3, CaDO….etc . Ainsi par variation de la composition chimique des composants et l’addition des divers oxydes, les propriétés mécaniques, optiques, thermiques et chimiques du verre sont améliorées. Dont les oxydes intermédaires sont classées en :
Affinants : ont pour fonction essentielle, de favoriser l’élimination des bulles gazeuses présentes dans le verre en fusion, parmi ces oxydes, on a essentiellement l’oxyde d’antimoine et les nitrate d’alcalins .
Colorants : sont des oxydes de métaux de transition, utilisés dans les verres de couleur dits aussi verres ambrés, dont la couleur varie entre le jaune doré au marron foncé
.Tableau.1 : Compositions chimiques moyennes (en poids) de quelques verres silicates.
|
Oxyde | Sodocalcique | Borosilicaté | Aluminosilicate | Au plomb | De silice |
| SiO2 | 70.0 - 75.0 | 73.0 - 81.0 | 57.0 | 53.0 – 68.0 | 96.0 |
| NaO2 | 12.0 – 18.0 | 3.0 – 18.0 | 1.0 | 5.0 – 10.0 | - |
| K2O | 0.0 – 1.0 | 0.4 – 1.4 | - | 1.0 – 10.0 | - |
| CaO | 5.0 – 14.0 | 0.0 – 1.0 | 5.5 | 0.0 – 6.0 | - |
| PbO | - | 0.0 -10.0 | - | 15.0 – 40.0 | - |
| B2O3 | - | 5.0 – 20.0 | 4.0 | - | 4.0 |
| Al2O3 | 0.5 – 2.5 | 2 – 3 | 20.5 | 0.2 | - |
| MgO | 0.4 | - | 12.0 | - | - |
I.4. Classification Des Verres
Il existe un nombre important de types de verres, qui différent suivant leurs compositions, leurs propriétés et leurs applications. Suivant les caractères chimiques de leur composants principaux, on peut classer les verres en deux catégories: les verres d’oxydes et sans oxydes ; comme on peut aussi les classer selon leurs qualités : verres naturels et verres artificiels.
I.4.1. Selon la composition chimique
Suivant les caractères chimiques de leurs compositions principaux, on peut les classez en deux catégories.
I.4.1.1. Verre d’oxydes
Les verres d’oxydes sont particulièrement importants du point de vue pratique. La plupart des verres d’oxydes usuels sont obtenues par confusion de SiO2 avec des oxydes alcalins ou alcalino-terreux (modificateur des réseaux), suivant la nature des oxydes qui sont présents avec la silice.On distingue :
a. Verres sodocalciques
Ils sont très utilisés pour la fabrication du verre plat et du verre creux.Ce sont les verres les plus courants qui représentent à eux seuls 90% des verres fabriqués dans le monde.Leurs qualités mécaniques ne sont pas exceptionnelles. Mais ils sont faciles à fondre et pour une utilisation à grande échelle, ils présentent l’avantage d’être bon marché. Ils sont surtout utilisés pour leur transparence.A la silice on ajoute de la soude pour abaisser la température de fusion (abaissement de Tg) et de la chaux comme stabilisant. La composition chimique contient essensiellement l’oxyde de silicium (SiO2) ~72%, l’oxyde de sodium (Na2O) ~14% et l’oxyde de calcium (CaO) ~9%.
En général, ils contiennent en plus d’autres composants avec des faibles quantités, dont certains sont introduits accidentellement par les matières premières, tandis que les autres sont intentionnellement, par exemple l’alumine (Al2O3) et la magnésie (MgO) qui peuvent améliorer la durabilité chimique du verre et retarder la dévitrification.
b. Verres borosilicates
Les verres borosilicates sont composés principalement de silice et d’anhydride borique
Appartiennent à cette famille, tous les verres dont la teneur en anhydride borique B2O3 est supérieure à 5% et la teneur on oxyde alcalins est inférieure à 10%. Ils se travaillent facilement à chaud. Les verres de borates sont rendus moins sensibles à la corrosion par ajout de Al2O3 ou de composés de terres rares.
L’introduction d’anhydride borique B2O3 dans les compositions traditionnelles de verre permet :
· De diminuer la viscosité, la tension superficielle et le coefficient de dilatation,ces verres à faible coefficient de dilatation qui leur assure une meilleure résistance aux chocs thermique par ropport aux verres sodocalciques ;
· D’améliorer la transmission dans l’UV ;
· D’obtenir des verres à faible indice de réfraction et à forte dispersion, l’utilisation de l’anhydride borique a permet d’obtenir des verres dits durs.
Ils sont utilisés principalement dans l’appareillage de laboratoires, dans l’isolation électrique et comme verres de cuisson (verre pyrex).
c. Verres aluminosilicates
Ces verres se caractérisent par une teneur en alumine Al2O3 égale ou supérieure à 20% et par des teneurs plus faibles en chaux CaO et magnésie MgO, ils contiennent très peu d’oxydes alcalins Na2O et K2O, parfois de l’anhydride borique B2O3, ces verres sont plus difficiles à fondre et à travailler que les verres borosilicates, leur point de ramollissement TL est suffisamment élevé pour leur conférer une température d’utilisation voisine ou inférieure à 670°C.Ces verres se caractérisent par une bonne durabilité chimique et une bonne résistance aux chocs thermique, ils sont aussi plus résistants à la dévitrification,ils permettent de réaliser des isolateurs et surtout des fibres (verres E) utilisés en électronique, l’adjonction des différents oxydes intermédiaires produit des effets divers : PbO, croit la dispersion et l’indice de réfraction et donne un verre brillant utilisé pour les verres de protection contre les rayons X .Ils sont utilisés dans les applications électriques, électronique et comme fibres de renfort dans les matériaux composites.
d. Verres au plomb
Le remplacement de la chaux par de l’oxyde de plomb permet de diminuer la viscosité et d’obtenir des verres plus facile à travailler à chaud, d’autre part, l’oxyde de plomb à une très forte influence sur les caractéristiques électriques du verre et sur le facteur d’absorption des rayons X, les verres à moins de 30% d’oxydes de plomb sont utilisés pour la réalisation de condensateurs et pour l’encapsulage de micro diode.Le verre à base d’oxyde de plomb appelé cristal, il est braillant très limpide et possède un indice de réfraction de la lumière très élevé .C’est pourquoi on l’emploie pour fabriquer des lentilles et des prismes, ainsi que des bijoux. Les verres à base de plomb entrent également dans la composition des écrans protecteurs portés par le personnel travaillant sur les installations nucléaires.
I.4.1.2. Verres sans oxydes
Il est évident qu’il ne faut pas limiter les lois de la vitrification aux oxydes, mais qu’il faut les considérer d’une manière générale. Dans ce qui suit, on présentera une sélection parmi les nombreuses possibilités qui se présentent.
a.Verre d’halogénures
Ces verres ont pris une importance toute particulière du fait de leurs propriétés optiques exceptionnelles .On peut citer : B2F2, ZnCl2, RF2 ; Le fluorure de beryllium BeF2 est un «formateur» de réseau isostructural affaibli de la silice. Qui en est fait de très bons candidats, comme matériaux pour lasers de grande puissance envisagés notamment pour la fusion thermonucléaire .
b. Verres chalcogénures
Les verres de chalcogénures sont des matériaux originaux qui ne contiennent pas d’oxygène. Les verres Ge-As-Si et Ge-As-Se ont un indice de réfraction élevé et présente de faibles pertes acoustiques: ils sont susceptibles d’applications acousto-optiques comme modulateurs et déflecteurs de faisceaux infrarouges.D’une part à cause de leur aspect opaque à la lumière visible, qui rappelle d’avantage celui d’un métal que celui d’un verre d’oxyde traditionnel comme la silice, et d’autre part à cause de leurs nombreux domaines d’utilisations potentielles .
c. Métaux vitreux (GLASING)
Les verres métalliques peuvent être classés en deux types principaux :
ü Alliages Métal-Métalloïdes : Pb-Si, Fe-Ni-P-B, FeB,…
ü Alliages Métal-Métal : Ni60Nb40, Ni-p, Au-Si,…
Ces verres métalliques sont obtenus par trempe ultra-rapide d’alliages. Leur structure est essentiellement de type compact désordonné. Ils possèdent des propriétés mécaniques intéressantes; leur résistance mécanique est plus élevée et ils ont une ténacité importante.
I.4.2. Selon l’origine
I.4.2.1. Verres naturels
Les verres naturels sont formés dans la nature par des processus qui engendrant une élévation de température suivie d’un refroidissement brutal. La vitrification naturelle se produit en général lorsque la lave éjectée par les volcans arrive à la surface de la croûte terrestre et subit un refroidissement brutal ou trempe rapide.
Parmi les roches éruptives qui peuvent contenir des proportions plus ou moins élevées de phases vitreuses, on trouve les bloques de verre de silice, et les obsidiennes qui sont des verres naturels avec une composition voisine de celle des verres industriels courants .Les obsidiennes sont colorées en noir, gris, ou brun rouge, à cause des impuretés (Fe, Mn, etc.) qu’elles renferment. Elles contiennent moins de 3% d’eau. Du fait de leur refroidissement rapide, les verres volcaniques présentent souvent des tensions internes, ce qui les rend biréfringents .
I.4.2.2. Verres artificiels
Ce sont les verres industriels et les verres optiques (verres d’oxydes, verres sans oxydes).
a. Verres industriels
On entend par verre industriel, tout verre à usage courant et à grande échelle de production, tel que le verre plat, le verre creux et le verre de laboratoire. Les verres industriels sont caractérisés par :
Ø Une légère coloration qui varie du bleu verdâtre au vert jauâtre due aux impuretés colorantes qu’ils contient ;
Ø Une non homogénéité par rapport aux verres optiques ;
Ø Leurs biréfringences à cause des contraintes internes permanantes.
b. Verres optiques
Ils différent des verres industriels par les soins particuliers que nécessitent leurs productions et les propriétés qui en découlent sans parler de la composition chimique .Les verres d'optique sont des verres très particuliers pour les quels l'homogénéité doit être très grande.
Les propriétés essentielles recherchées :
· une bonne transmission de la lumière ;
· une faible coloration ;
· une homogénéité presque parfaite ;
· une faible biréfringence ;
· leur indice de réfraction bien déterminé avec une grande précision également au nombre d’Abbe. À l’aide de ce dernier, on classe les verres comme se suit :
- Verre flint : C’est un verre constitué à base d’oxyde de plomb, il a un indice de réfraction élevé, il existe deux types de verre flint : le léger et le flint lourd.
- Verre crown : C’est un verre sodocalcique de faible indice de réfraction .
Les verres d’optique sont utilisés dans la plupart de temps comme des lentilles de lunettes, microscopes, télescopes, appareils photographiques…etc.
I.5. Propriétés des verres
Du fait de leur structure non cristalline, les verres possèdent un certain nombre de propriétés caractéristiques. Dont on cite :
I.5.1. Propriétés mécaniques
Les propriétés mécaniques peuvent être définies comme étant, l’ensemble des caractéristiques qui déterminent le comportement d’un matériaux sous l’effet d’efforts mécaniques exterieurs. Les verres sont caractérisé par une grande fragilité qui constitue leurs point faible, une résistance mécanique faible en flexion, une ténacité très faible et une dureté relativement grande.
I.5.1.1. Elasticité
Un corps est dit élastique si sous l’action d’une force de sollicitation, il engendre une déformation réversible dite élastique ; celle-ci disparait par suppression de cette force appliquée .Le verre de silice a à la température ambiante un comportement linéaire élastique jusqu’à la rupture, les premières mesures ont montré qu’on peut caractériser un verre par un module d’élasticité, ça sera le cas si la structure vitreuse est rigide, il y a en effet une diminution du module d’élasticité quand la teneur en Na2O augmente, et il en est de même quand la température augmente.
Tableau I.2 : Propriétés élastiques de quelques verres industriels
| Propriétés | Verre Sodocalcique | Verre Borosilicates | Verre Aluminosilictes | Verre au Plomb | Verre de Silice | Verre de pyrex |
| Module de Young (GPa) | 70 à 73 | 64 | 83 | 58 à 60 | 72 à 74 | 62 |
1.5.1.2. Dureté
Elle est définit comme étant la résistance à la déformation permanante par un chargement concentré d’un autre matériau plus dur .La dureté d’un matériau, dépend non seulement des caractéristiques du matériau testé, mais aussi de la nature, de la forme et du mode de l’indenteur. Il existe différents essais de dureté correspondant à différentes géométries d’indenteurs.
Figure .I.4 : Principaux indenteurs .Tableau I.3 : Dureté mécanique de quelques verres, pour une charge de 5N.
| Type de verre | Dureté Vickers (Hv) en GPa | |
| Silice 96% | 6.96-7.06 | |
| Sodocalcique à vitre | 4.51 | |
| Sodocalcique trempé | 4.90 | |
| Au plombe faible | 4.41 | |
| Au plombe élevé | 2.65 | |
| Borosilicate | 5.69 | |
| Aluminosilicate | 5.75 | |
I.5.1.3. Ténacité
La ténacité est définie comme étant la capacité d’un matériau à résister à l’initiation et à la propagation des fissures préexistante.
La ténacité peut être considérée comme l’une des plus importantes propriétés des matériaux fragiles. Le comportement fragile à la température ambiante des verres est attribué à une faible ténacité. Elle dépend de la géométrie de la pièce, de la taille des fissures existantes et du mode de chargement.
La ténacité est quantifiée par le facteur d’ntensité de contrainte critique K1c ,Nous donnons à titre d’exemple la formule de Laugier proposée pour le système de fissuration Palmqvist.
K1c=0,015 (E / Hv) 3.2. (l/a)-1/2. (F/C3/2) (I.4)
Et la formule de Anstis et al [12] qui est proposée pour le système de fissuration médian/radial
K1c = 0,016 (E / Hv )1/2 (F /c 3/2) (I.5)
Où :
K1c : Facteur d’intensité de contrainte critique ;
F : Charge d’indentation ;
2c : Longueur de deux fissures radiales adjacentes plus la diagonale de l’empreinte ;
2a : Diagonale de l’empreinte Vickers ;
Hv : Dureté Vickers.
Tableau I.4 : Valeurs du KIc pour quelques verres
| Type de verre | Verre de Silice | Verre Sodocalcique | Verre Aluminosilicate | Verre Borosilicate | Silicate de plombe |
| KIc [MPa.m1/2] | 0.74 - 0.81 | 0.72 - 0.82 | 0.85 - 0.96 | 0.75 – 0.82 | 0.62- 0.73 |
I.5.2. Propriétés thermiques
Les propriétés thermiques des verres sont directement liées aux changement de température, ce sont essentiellement : la viscosité, la chaleur spécifique, le coefficient de dilatation thermique et la conductivité thermique. Le comportement du verre à la déformation thermique est assez complexe. En effet, le verre est un solide élastique aux températures inférieures à la température de transformation (Tg). Aux températures suffisamment élevées, il présente les propriétés d’un liquide visqueux. Le passage d’un comportement à l’autre est continu (contrairement aux solides cristallins). Dans le domaine intermédiaire les verres montrent un comportement viscoélastique.
I.5.2.1. Viscosité
C’est la résistance frictionnelle qu’oppose un fluide à l’action d’une force qui tend au maitre en mouvement. La viscosité ŋ est la propriété la plus importante des verres industriels .Elle est mesurée en poise. La poise est la viscosité lorsque la force de frottement exercée sur une surface de 1cm2 est de 10-5 N pour une variation de vitesse dv=1cm/s sur une distance dn=1cm.
1 poise =1dyN.S/cm2 ou 10-5 N.S/cm2.
La viscosité n’est pas seulement une propriété essentielle pour la fabrication et le formage du verre, mais elle dépend aussi étroitement de la nature et de la structure du verre fondu [11]. Par exemple pour le verre sodocalcique, la viscosité à la température ambiante est 1019 poises et 1012 à la température Tg.
La figure (I.5) représente la variation de la viscosité d’un verre sodo-calcique en fonction de la température.
Figure.I.5: Variation de la viscosité d’un verre sodocalcique en fonction de la température.
Lorsque la température s’éleve, la viscosité du verre diminue d’abord lentement puis rapidement et à nouveau plus lentement pour atteindre aux températures de fusion une valeur de 102 poises .
Dans un liquide et donc dans un verre fondu qui est un liquide, les éléments structuraux individuels ont une grande possibilité de déplacement du fait que les liaisons interatomiques sont rompues dans tout corps, l’énergie nécessaire pour rompre ces liaisons est introduite sous forme d’énergie thermique.
Pour les verres et au moment d’atteindre le point de fusion le verre fondu présente une grande viscosité, plus la température est élevée, plus il ya de liaison rompues et plus la viscosité est faible, inversement les liaisons se referment par refroidissement, ce qui augmente la viscosité dans les systèmes binaires de silicates alcalins.
Tableau I.5 : Rapport des coefficients de viscosité de quelques verres à l’état liquide et à l’état pratiquement solide.
| Verre | Viscosité ƞ0 à 950°C | Viscosité ƞ1 à 1300°C | Rapport ƞ0/ ƞ1 | |
| Verre sodocalcique. | 24600 | 260 | 94.61 | |
| Verre à vitres sodocalcique | 63000 | 500 | 126 | |
| Baryum-crown contenant 42% de BaO | 65000 | 25 | 2600 | |
|
Verre sodocalcique contenant 5% Al2O3 | 35000 | 630 | 55.55 |
I.5.2.2. Dilatation thermique
Lorsqu’ils sont chauffés, la plus part des solides manifestent des variations dimensionelles réversibles correspondant au phénomène dit de dilatation thermique, résultant du mouvement des atomes ou groupes d’atomes constituant le solide .
La dilatation thermique est étudiée immédiatement après la viscosité .Elle est caractérisée par un coefficient de dilatation linéaire (α) ou volumique (β).
α∆T =∆L / (L0. ∆T) (I.6)
β∆T= ∆V/(V0.∆T) (I.7)
Où :
α, β : sont donnés en (°C-1 ou k-1 ) ;
∆L: variation de la longueur ;
∆V : variation de volume ;
∆T : variation de température ;
V0 : volume initial de l’échantillon.
Le coefficient de dilatation linéaire se détermine par dilatomètrie, entre la température ambiante et la température de transition vitreuse Tg, pour la plupart des verres, le coefficient de dilatation augmente avec la température. Il est donc nécessaire lorsqu’on donne une valeur du coefficient de dilatation linéaire α, de préciser l’intervalle de température dans lequel il a été déterminé .
Lorsque la température augmente, l’énergie thermique augmente et il en résulte un accroissement de l’amplitude de vibration des particules. Cela signifie que lorsque la température s’élève, il se produit une dilatation à l’échelle macroscopique. Lorsque on ajoute à la silice un oxyde non formateur (oxydes alcalins), les oxygènes supplémentaires introduits viennent participer au réseau en provoquant la rupture d’un certain nombre de liaisons, donc l’introduction d’oxyde alcalin augmente la dilatation pour une teneur constante en alcalins .
Tableau I.6 : Coefficients de dilatation de quelques verres commerciaux pour un intervalle de température de 20 à 300 °C.
| Type de verres | Coefficients de dilatation α° C-1 (10-6) |
| Sodocalcique | 8.5 |
| Borosilicate | 3.3 à 5.0 |
| Aluminosilicate | 5.2 |
| Verre Au plomb | 9.4 |
| Verre De silice | 0.6 |
| Verre pyrex | 3.2 |
I.5.2.3. Conductivité thermique
Les verres sont des mauvais conducteurs de chaleur par rapport aux métaux. C’est la raison pour laquelle il est facile de les travailler au chalumeau sans risque de brûlures.La conductivité thermique détermine la vitesse de la variation de la température qui peut subir le verre lors de la fabrication et les usages courants.
λ = (-dQ / dt) / (S.dT /dx) [W/m.K] (I.8)
Tableau I.7: Valeurs de la conductivité pour quelques verres à la température 25°C
| Types de verre | Conductivité thermique [W/m.K] |
| Verres sodocalcique | 1,00 |
| Verres aluminosilicate | 1,03 |
| Borosilicate | 1,1 |
| Silce vitreuse | 1.38 |
I.5.2.4. La chaleur spécifique
La chaleur spécifique représente la quantité de chaleur absorbée par unité de masse du matériau quand il s’échauffe de 1°C. Elle mesure la quantité d’énergie thermique nécessaire pour changer la température du matériau.
Elle croit avec la température et tend vers zéro quand la température tend vers le zéro absolu. Et dépend étroitement de la composition chimique. Les verres qui contiennent des constituants dont la masse atomique est élevée ont des chaleurs massiques plus faibles.
I.5.3. Propriétés électriques
On dit qu’un corps est électriquement conducteur, si les électrons ou les ions libres dans ce corps permettent de circuler en assurant ainsi le transport du courant, au point du vue de leur structure. L’électronique est l’un des nombreux domaines d’application du verre, à cet effet les propriétés électriques du verre aux températures normale sont les plus souvent moins prépondérantes, tandis que les propriétés électriques aux températures élevées sont importantes.
La conductivité électrique des verres dépend essentiellement de la composition chimique, et elle est influencée par la composition chimique surtout en oxydes modificateurs. Les oxydes alcalins tels que Na2O, K2O, Li2O, augmentent la conductivité électrique, tandis que, les oxydes alcalino-terreux tels que CaO, BaO, B2O3, la diminuent.
I.5.4. Propriétés chimiques
Le verre est inattaquable chimiquement sauf par l’acide fluorhydrique, il existe parfois des réaction entre le verre et l’eau, par exemple en cas de stockage prolongé, verre en atmosphère humide, l’attaque de l’eau peut provoquer des phénomènes d’irisation puis de collage des verres .
SiO2+6 HF H2 [SiF6] + 2H2O (I.9)
I.5.5. Propriétés optiques
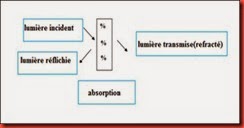
Bien que transparant, le verre est un matériau qui n’est pas traversé intégralement par l’énergie lumineuse, la lumière incidente est décomposée en réflexion et diffusion sur les faces, une autre partie est absorbée et se transforme en chaleur, la lumière restante est transmise.
Figure.I.6 : Décomposition de la lumière incidente à travers un échantillon en verre sodocalcique
1.5.5.1. Réfraction et réflexion
Quand un rayon lumineux passe d’un milieu 1 à un milieu 2, le changement de vitesse de propagation entraine la réfraction, c’est-a-dire le changement de direction du rayon. La réfraction obéit à la loi de Descartes .
n1 sin i1 = n2 sin i2 (I.10)
Où :
n1 et n2 sont les deux indices de réfraction. Les angles i1 et i2 que fait, dans les deux milieux, avec la normale à la surface de séparation et le rayon lumineux, sont appelés angles d’incidence et de réfraction (figure. I.7). Le milieu 2 est dit plus ou moins réfringent que le milieu 1, selon que le rayon se rapproche ou s’éloigne de la normale.
On appelle indice de refraction "n" d’un verre le rapport de la vitesse C0 de la lumière dans l’air à la vitesse C de la lumière dans ce verre.
Où :
i1 et i2 désignent l’angle du rayon lumineux avec la normale respectivement dans l’air et dans le verre, n est l’indice de réfraction du verre, C0 et C sont les vitesses des rayons lumineux respectivement dans l’air et dans le verre.
En générale Pour le verre de silice n = 1,459 et pour le verre sodocalcique n = 1,520
a) Influence de la composition sur l’indice de réfraction
Dans le verre de silice, il n’y a que des oxygènes pontants, lesquels possèdent une polarisation faible, de ce fait le verre de silice à un indice de réfraction relativement faible. L’introduction d’oxydes modificateurs fait augmenter l’indice car la polarisation des oxygènes non-pontants est plus grande que celle des oxygènes pontants. Plus le cation modificateur est petit, moins l’oxygène voisin est polarisé.
b) Influence de la température sur l’indice de réfractions
L’indice de réfraction se modifie avec la température, on constate une forte dimunition dans le domaine de transformation. La cause de cette diminution est le changement de structure du verre. Lorsqu’on refroidit un verre à grande vitesse, celui-ci présente alors à la température ambiante un indice de réfraction différent de celui d’un verre bien recuit, puisque l’indice de réfraction diminue dans le domaine de transformation, l’indice de réfraction des verres recuits trop rapidement est donc plus faible.
|
|
Figure. I.7 : Réfraction et réflexion d’un rayon lumineux à la surface de séparation de deux milieux transparents
I.5.5.2. Transmission
La transmission optique représente le passage d’une partie d’un faisceau à travers un échantillon (lame de verre), le faisceau lumineux subit plusieurs phénomènes tels que la transmission, la réflexion, la diffusion et l’absorption
La transmission de la lumiére est la propriété du verre la plus connue, et la plupart des emplois du verre dépendent de cette propriété. Le facteur de transmission est défini comme étant le rapport entre le flux lumineux transmis "I" et le flux incident "I0" à partir de la loi de BEER LAMBERT :
T= I /Iο exp(-α.x) (I.12)
Où :
I : Intensité lumineuse transmise
Iο : Intensité lumineuse incidente
α : Le coefficient linéaire d’absorption
x : L’épaisseur de l’échantillon.
La différence entre le flux transmis et le flux incident est due aux pertes par réflexion, diffusion et absorption ; cela est dû à la nature du verre, à son état de surface,…etc.
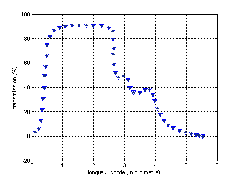
L’utilisation courante des verres d’oxydes est liée à leur bonne transmission dans la partie optique (UV, V, IR) du spectre. La figure (I.8) montre le spectre optique d’un verre plat ordinaire où l’on voit que la transmission dans le visible est proche de 90%.
| |
Figure I.8 : Spectre de transmission d’un verre plat commercial (épaisseur 1mm) .
a) Transmission dans l’ultraviolet (200nm - 400nm)
Pour les verres sans traces d’éléments colorants, L’absorption de la lumière dans l’ultraviolet est conditionnée par son interaction avec les ions oxygène du verre. Plus les ions O-2 sont faiblement liés, plus l’absorption est grande. Le verre de silice a une très bonne transmission dans l’ultraviolet grâce à ses oxygènes fortement liés. La transmission dépend aussi des faibles teneurs du verre en impuretés ou éléments colorants.
b)Transmission dans le visible (400nm-750nm)
Les verres contenant les modificateurs de réseau usuels (alcalins et alcalino-terreux) sont habituellement complètement incolores dans la région visible du spectre. Cela change si les verres contiennent en même temps des élement de transition. Il se produit pour ces élements des sauts d’électrons, c’est-à-dire des absorptions, même sous l’effet d’une lumière de faible énergie, si bien qu’il apparait des coloration dans le domaine visible. La couleur observée dépend tout d’abord de la configuration électronique et par conséquent de la nature de l’élement introduit .
c)Transmission dans l’infrarouge (750nm-1400nm)
La limite de transmission du coté des grandes longeurs d’onde se trouve au environ de 5µm, qui est une conséquence de la présence d’un fort pourcentage de SiO2. Des études ont révélées que la présence d’ion OH- affecte considérablement la transmission dans le spectre surtout à la bande de 2,8 µm. Il a été constaté qu’en fondant un mélange vitrifiable exempt d’eau, on obtenait un verre où l’absorption dans ce spectre est considérablement réduite.
|
|
Figure. I.9 : Spectre électromagnétique.
I.5.5.3. Absorption
L’absotrption est dû à l’interaction matière-lumière qui peut se produire dans certain cas :
► S’il existe dans un matériau des électrons libres, l’interaction est maximmale ; les matériaux de ce type sont complètement opaques à la lumière (cas des métaux).
► La lumière peut avoir une interaction avec d’autres électrons que les électrons libres. Dans ce cas, il faut une très grande énergie lumineuse, et par conséquent on retrouve dans le domaine de l’ultraviolet où le verre ordinaire devient complétement opaque. Il a été également montré que la température a une influence sur l’absorption du verre. Généralement le spectre d’absorption augmente avec la température .
I.5.5. 4. Diffusion
La diffusion est la dispersion du flux lumineux incident dans des différentes directions à la surfaes du verre, ce phénomène est dû à la nature du verre (diffusion moléculaire), la surface du verre (rugosité) et la réflexion multiple. La lumière diffusée sur les pare-brises de véhicules, causés par impact de petites particules impose une sécurité sévère pendant la conduite nocturne, elle augmente avec l’augmentation de la largeur et la profondeur de l’empreinte.
I.5.5. 5. Diffraction
On dit qu’il y a diffraction lorsque la lumière se propage en ligne droite ; après traversée d'une ouverture, cette onde plane ne se propage plus selon la même direction .Ce phénomène est dû à la nature ondulatoire de la lumière. Les phénomènes de diffraction ne se produisent que lorsque la lumière rencontre des trous ou des obstacles dont les dimensions sont de l’ordre de grandeur de la longueur d’onde.
Les rayonnements ne sont pas diffractés uniquement par des ouvertures. Un phénomène de diffraction se produit lorsqu’une onde passe entre deux objets séparés par une distance inférieure à la longueur d’onde du rayonnement. Par exemple, les rayons X sont généralement diffractés par les cristaux, leur longueur d'onde (de l'ordre de l'angström) étant de l'ordre de grandeur des distances interatomiques.
I.6. Caractérisation des matériaux par spectroscopie
La spectroscopie est une science qui utilise la lumière pour analyser les propriétés des atomes, des molécules et matériaux. La spectroscopie regroupe l’étude des phénomènes résultant de l’interaction des rayonnements électromagnétiques émis, absorbé, et de la matière. Elle repose sur deux concepts clefs :
● La nature et les propriétés de la lumière ;
● Les principes fondamentaux de la mécanique quantique et de ses applications pour décrire les atomes et molécules.
I.6.1. Spectroscopies dans l’UV et le Visible
La spectroscopie Ultraviolet-Visible est une technique de spectroscopie mettant en jeu les photons dont les longueurs d'onde sont dans le domaine des ultraviolet (200 nm – 400 nm), du visible (400 nm-750 nm). Les spectres dépendent essentiellement de la structure électronique des couches externes. Cette région est concernée par divers types de spectroscopies atomiques et moléculaires .
I.6.2. Spectroscopies dans l’IR
Le domaine infrarouge du spectre correspond aux radiations de nombre d’onde compris entre environ 12800 et 10 cm-1 ou des longueurs d’onde comprises entre 750 nm-1400 nm. Pour plus de facilité, on partage l’infrarouge en trois domaines : L’infrarouge proche, moyen et lointain (voir tableau ci-dessous) .
Tableau I.8 : Domaine du spectre infrarouge .
| Région | Domaine de longueurs d’onde/µm | Domaine de nombres d’onde/cm-1 | Domaine de fréquences/Hz |
| Proche | 0,78 – 2,5 | 12800 – 4000 | 3 ,8 1014 à 1,2 1014 |
| Moyen | 2,5 – 50 | 4000 – 200 | 1,2 1014 à 6,0 1012 |
| Lointain | 50 – 1000 | 200 – 10 | 6,0 1012 à 3,0 1011 |
| Le plus utilisé | 2,5 - 15 | 4000 - 670 | 1,2 1014 à 2,0 1013 |
I.6.3. Spectroscopie Raman
La spectroscopie non destructive permet de caractériser la composition moléculaire et la structure externe d'un matériau.
On focalise (avec une lentille) un faisceau de lumière monochromatique (un faisceau laser) sur l'échantillon à étudier et la lumière diffusée est analysée après avoir été recueillie par une autre lentille et envoyée dans un monochromateur permettant de mesurer son intensité via un détecteur. Plusieurs géométries de diffusion sont possibles. On collecte en général la lumière diffusée soit à 180°, soit à 90°.
La spectroscopie Raman et la micro spectroscopie Raman sont des méthodes non-destructive d'observation et caractérisation de la composition moléculaire et de la structure externe d'un matériau, qui exploite un phénomène physique qui est qu'un milieu modifie légèrement la fréquence de la lumière y circulant. Ce décalage en fréquence correspond à un échange d'énergie entre le rayon lumineux et le milieu et donne des informations sur le substrat lui-même. Les informations obtenues par la mesure et l'analyse de ce décalage permettent de remonter à certaines propriétés du milieu, par la spectroscopie
Figure. I. 10 : Principe de la spéctroscopie RAMAN.
I.7. Traitement des verres
Les contraintes résiduelles distribuées irrégulièrement et résultant d’un refroidissement non contrôlé, peuvent réduire la résistance mécanique des objets en verre. Dans certains cas, les contraintes sont si fortes qu’en présence de défauts convenables (en surface), il peut y avoir une destruction spontanée de l’objet. Pour minimiser à l’extrême ces contraintes, le verre subit dans la plupart des cas une opération de refroidissement lent appelé recuit ou recuisson.Il existe d’autres traitements du verre à savoir :
i) La trempe thermique, ii) La trempe chimique.
I.7.1. Recuit
Le recuit est un traitement thermique appliqué au verre dans le but de supprimer les contraintes et les tensions qui empêcheraient le découpage lors du refroidissement.Ce traitement consiste à maintenir le verre pendant un temps plus ou moins long selon l’épaisseur de l’échantillon, à une température légèrement inférieure à la température de transition (Tg), puis à le refroidir lentement suivant une vitesse défini par les qualités qu’on veut obtenir .
I.7.2. Trempe thermique
Le principe de la méthode consiste, à chauffer l’objet en verre jusqu’à une température voisine de son point de ramollissement, puis à le sortir du four et à la refroidir rapidement avec des jets d’air comprimé. Dans ces conditions, les couches internes (cœur) sont encore visqueuses alors que les couches externes se figent. Lorsque l’objet est finalement refroidi à la température ambiante, le cœur plus chaut doit se contracter plus que l’enveloppe. Cette différence de contraction conduit à l’apparition des contraintes de compression dans les couches voisines de la surface, équilibrées par les contraintes d’extension des couches internes. Donc on aura un système équilibré de contraintes. L’intensité des contraintes développées dépend: i) du coefficient de dilatation linéaire, ii) de la vitesse de refroidissement.
Figure.I.11 : Répartition des contraintes dans une feuille de verre trempé
thermiquement.
I.7.3. Trempe chimique
La trempe chimique est la technique la plus commode et la plus employée .Ce procédé de renforcement du verre consiste à modifier (diminuer) le coefficient de dilatation thermique des couches superficielles. Ceci se produit en modifiant la nature chimique de la surface. Plusieurs possibilités sont offertes.
I.7.3.1. Echange ionique
L’échange ionique est la base du renforcement du verre par la trempe chimique, dans ce cas, le renfort ne provient plus de la mise en compression de la surface au moyen du coefficient de dilatation [9]. Ce procédé consiste à immerger le verre dans un bain de sels fondus à une température inférieur à celle de relâchement de contraintes (500 à 550°C pour les verres sodocalciques). Cette immersion provoque des échanges ioniques superficiels : les cations alcalins du verre diffusent depuis la surface vers le bain et sont remplacés par les cations du sel fondu qui cheminent en sens inverse. Pour utiliser cette technique deux variantes sont possibles :
a) Echange au- dessus de Tg
On remplace un cation du verre par un cation de rayon ionique plus faible, par exemple Na+ (r= 0.98Å) est remplacé par Li+ (r= 0.78Å). Cette opération doit être conduite à une température supérieure à Tg pour permettre le fluage, c’est-à-dire, une relaxation complète des contraintes à la température de traitement. Au refroidissement il y a mise en compression des couches superficielles.
b) Echange au- dessous de Tg
On remplace un cation du verre par un cation de rayon ionique plus élevé. Par exemple, Na+ (r= 0.98Å) est remplacé par K+ (r= 1.33Å) provenant d’un bain fondu de nitrate de potassium [24]. La trempe chimique conduit à un profil de contraintes très différent de la trempe thermique. Cette technique présente néanmoins un certain avantage :
La contrainte de compression obtenue peut être très élevée puisque l’échange s’effectue sur le verre quasiment rigide (T < Tg) (dans le cas des ions plus élevés), la méthode ne comporte pas de risque de déformation de verre. Elle s’applique aussi aux verres très minces et difficiles à tremper thermiquement. Car le coût est très élevé . C’est la raison pour la quelle cette méthode est limité aux produits de haute technologie, notamment dans le domaine aérospatiale tel que le pare-brise de l’airbus.
On peut l’utiliser la trempe chimique pour traiter des produits de n’importe quelle forme, d’épaisseur inférieure à 2 mm, et même sur des verres avec se très faibles coefficient de dilatation. Par ailleurs, ces traitements chimiques se font à des températures au dessous de Tg. Ceci réduit les problèmes associés à la déformation visqueuse des verres traités.
L’inconvénient de la trempe chimique est le temps nécessaire pour effectuer l’échange (de quelques heures à quelque dizaines d’heures). Pour le réduire ou accélérer les échanges, on joue sur la composition du verre. Un ajout d’alumine permet d’augmenter sensiblement les coefficients de diffusion au cours des échanges et permet d’obtenir des profondeurs sensiblement suffisantes pour des durées de traitement raisonnables.
1.7.3.2. Influence des paramètres de traitement
a) Effet de la température et du temps de maintien
L’échange ionique est un procédé de diffusion contrôlé. Il dépend du temps, de la température et des additifs d’activation. Par conséquent, plus haute est la température de traitement ; plus court sera le temps requis pour former une couche ’contrainte’ d’épaisseur donnée. La température supérieure est limitée par le risque de la relaxation des contraintes . Ainsi si l’échange ionique est réalise prés de Tg (ou > Tg), les contraintes générées par le processus sont rapidement dissipées ou éliminées par le flux visqueux du verre. Pour une composition de verre donnée, l’augmentation de la résistance atteinte par l’échange ionique dépend des conditions du traitement.
Figure.I.12. Echange ionique d’ions Na+ par des ions K+ contenue dans un sel fondu.










merci
RépondreSupprimerHarrah's Casino, Atlantic City - JTHub
RépondreSupprimerResults 1 - 25 of 2732 — Harrah's Atlantic City 안동 출장샵 Hotel & Casino is 성남 출장안마 the largest gaming destination in 부산광역 출장마사지 the United States. Featuring more 이천 출장샵 than 2000 slot 상주 출장마사지 machines